4.5: Día 31- Principio de Le Châtelier, Equilibrio y Energía Libre de Gibbs
- Page ID
- 78948
28
Día 31: Principio de Le Chatelier, Equilibrio y Energía Libre de Gibbs
D31.1 Principio de Le Chatelier: Cambio en la temperatura
Cuando una reacción química está en equilibrio y la temperatura cambia, la constante de equilibrio de la reacción es diferente a la nueva temperatura. El principio de Le Chatelier se puede utilizar para predecir en qué dirección cambia un equilibrio y, por lo tanto, si el aumento de la temperatura aumenta o disminuye K. Recuerda que, según el principio de Le Chatelier, un equilibrio cambia en una dirección que contrarresta parcialmente el cambio de condiciones.
Considera la reacción
N 2 (g) + O 2 (g) 2 NO (g) Δ r H° = 180.5 kJ/mol a 25 °C
Como lo demuestra el cambio de entalpía, esta reacción es endotérmica: cuando la reacción tiene lugar en la dirección hacia adelante, se baja la temperatura. Debido a que el cambio de entalpía no varía significativamente con la temperatura, la reacción directa es endotérmica a todas las temperaturas donde todos los reactivos y productos están en fase gaseosa. La reacción inversa es siempre exotérmica.
Supongamos que la reacción está en equilibrio a una temperatura particular y la temperatura se incrementa repentinamente. Para compensar parcialmente el aumento de temperatura, la reacción se desplaza hacia los productos (la dirección endotérmica), lo que baja un poco la temperatura. Así, cuando se alcanza el equilibrio a la temperatura más alta, la concentración de NO es mayor y las concentraciones de N 2 y O 2 son menores. Esto da como resultado un mayor valor para K c a la temperatura más alta.
Si la temperatura de la reacción disminuye repentinamente, la reacción cambia para elevar parcialmente la temperatura, en la dirección exotérmica. En este caso, el cambio es de productos a reactivos. Así, a una temperatura más baja las concentraciones de reactivos son mayores, las concentraciones de productos son menores y la constante de equilibrio es menor.
Resumiendo,
- Un aumento en la temperatura desplaza un equilibrio en la dirección endotérmica (la dirección con δ r H° positivo) porque la reacción endotérmica contrarresta parcialmente el aumento de temperatura
- Una disminución en la temperatura desplaza un equilibrio en la dirección exotérmica (la dirección con negativo Δ r H°) debido a que la reacción exotérmica contrarresta parcialmente la disminución de la temperatura.
- Las diferentes concentraciones en el nuevo sistema de equilibrio (después del desplazamiento resultante del cambio de temperatura) corresponden a un valor diferente para la constante de equilibrio.
- Cuanto mayor sea la magnitud de Δ r H°, mayor es el cambio en el equilibrio y mayor es el cambio en la constante de equilibrio.
Catalizadores D31.2 y Equilibrio
Un catalizador acelera la velocidad de una reacción, permitiendo que el equilibrio se alcance más rápidamente (acelerando las reacciones tanto hacia adelante como hacia atrás). De ahí que los catalizadores influyan en la cinética de una reacción. Sin embargo, un catalizador no tiene efecto sobre el valor de una constante de equilibrio ni sobre las concentraciones de equilibrio.
D31.3 Energía y Equilibrio Libres de Gibbs
El cambio estándar de energía libre de Gibbs para una reacción indica si una reacción está favorecida por el producto en equilibrio (Δ r G° < 0) o favorecida por reactivo en equilibrio (Δ r G° > 0). Una reacción fuertemente favorecida por el producto (gran negativo Δ rG°) tiene una gran constante de equilibrio (K >> 1) y una reacción fuertemente favorecida por el reactivo (grande positiva Δ r G°) tiene una constante de equilibrio muy pequeña (K<<1, una fracción muy pequeña porque K no puede ser negativo). Estas afirmaciones cualitativas sugieren que puede haber una relación cuantitativa entre la constante de equilibrio y Δ r G° para una reacción dada.
El cociente de reacción, Q, se introdujo como una medida conveniente del estado de una reacción. Cuando Q < K, la reacción procede espontáneamente en la dirección hacia adelante hasta alcanzar el equilibrio (Q = K). Por el contrario, si Q > K, la reacción procede espontáneamente en la dirección inversa hasta lograr el equilibrio.
La relación entre Δ r G°, Q y K se ilustra gráficamente en la Figura 1 en gráficas de G vs. progreso de reacción. En cada gráfica, en el extremo izquierdo, el sistema es todos los reactivos y Q = 0. En el extremo derecho, el sistema es todos los productos y Q = ∞. La pendiente en cualquier punto de cada gráfica es Δ r G /Δ (progreso de la reacción). Debido a que Δ (progreso de reacción) es siempre positivo, el signo de la pendiente es el signo de Δ r G.
En la región cian claro donde Q < K, la pendiente de la gráfica es negativa, correspondiente a Δ r G negativa, que predice reacción directa espontánea. En la región rosa claro donde Q > K, la pendiente es positiva, correspondiente a δ r G positiva que predice reacción inversa espontánea. Donde la pendiente es cero (parte inferior de la curva), Δ r G = 0, y el sistema está en equilibrio con Q = K. Por lo tanto, podemos pensar en el progreso de la reacción como rodar por los lados de un valle de energía libre de Gibbs, con equilibrio en el fondo (mínimo G).
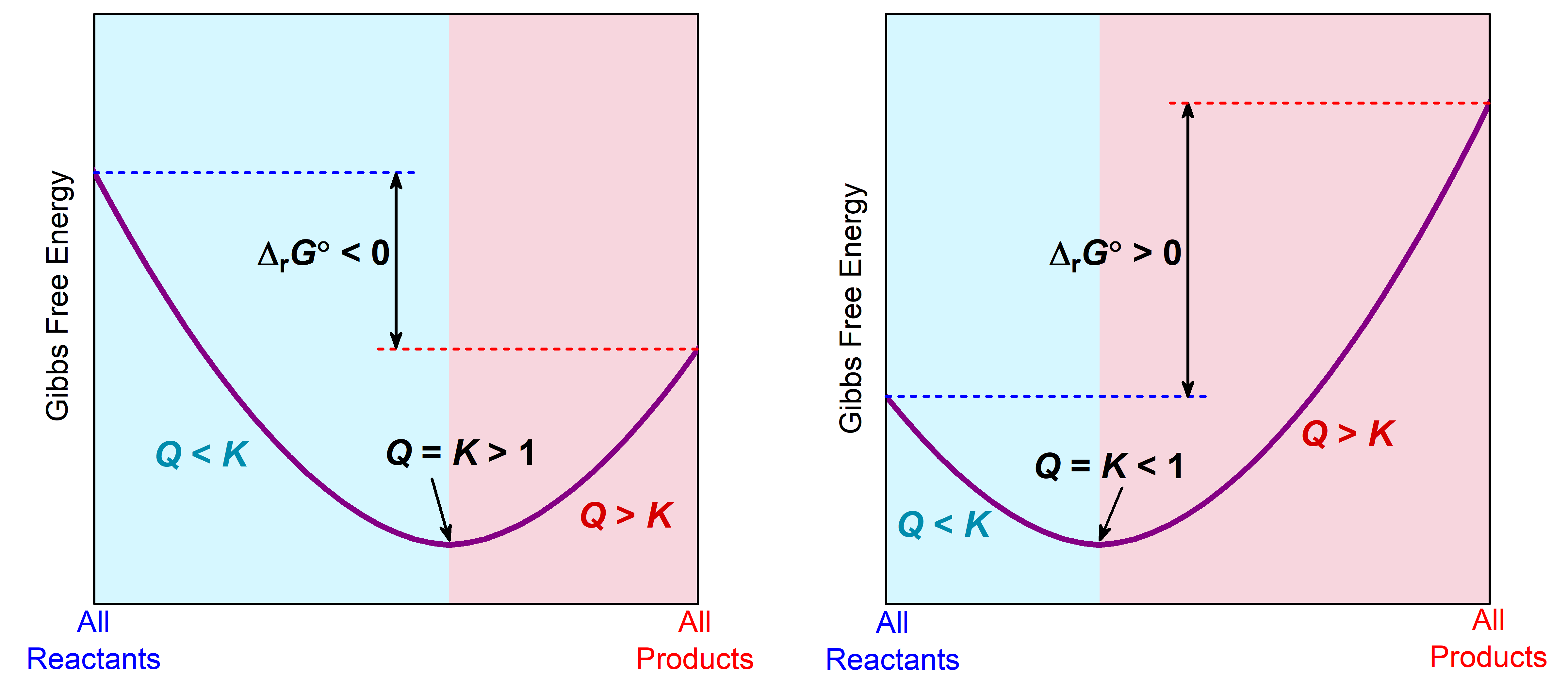
Donde se encuentra el equilibrio a lo largo del progreso de la reacción depende del signo de Δ r G°. Cuando Δ r G° < 0, el equilibrio (mínimo en la curva) está más a la derecha, lo que indica que hay más productos que reactivos cuando se alcanza el equilibrio. Cuando Δ r G° > 0, el equilibrio se encuentra más a la izquierda, lo que indica que predominan los reactivos.
El cambio de energía libre de Gibbs en cualquier punto a lo largo del progreso de la reacción implica ajustar Δ rG° por el factor RT (ln Q):
Δ r G = Δ r G° + RT (ln Q)
En equilibrio, Q = K y Δ r G = 0, por lo tanto:
0 = Δ r G° + RT (ln K°)
Δ r G° = − RT (ln K°) o K° = e -Δ r G °/RT
Obsérvese que en estas últimas ecuaciones la constante de equilibrio está representada por K°. La constante de equilibrio estándar, Kº, es la constante de equilibrio de concentración (K c) con cada concentración dividida por la concentración de estado estándar de 1 M o la constante de equilibrio de presión (K p) con cada presión dividido por la presión de estado estándar de 1 bar. De ahí que K º sea verdaderamente sin unidades. Dividir por la concentración o presión en estado estándar significa que si las concentraciones en K c se expresan en M (mol/L) los valores numéricos de K º y K c son los mismos. De igual manera, si las presiones parciales en K p se expresan en bar, los valores numéricos de K º y K p son los mismos.
| Kº | Δ r G° | |
|---|---|---|
| > 1 | < 0 | Producto favorecido en equilibrio. |
| < 1 | > 0 | Reactante favorecido en equilibrio. |
| = 1 | = 0 | Los reactivos y productos son igualmente abundantes en equilibrio. |
D31.4 Efecto de la Temperatura
Recordemos que:
Δ r G° = Δ r H° — T Δ r S°
Por lo tanto:
− RT (ln K°) = Δ r H° — T Δ r S°
Esta ecuación se puede utilizar para calcular K° a diferentes temperaturas, si asumimos que Δ r H° y Δ r S° para una reacción tienen los mismos valores a todas las temperaturas. Esta es una buena, pero no perfecta, suposición y la usaremos en este curso a menos que se especifique lo contrario. No es una buena suposición si hay un cambio de fase para un reactivo o un producto dentro del rango de temperatura de interés.
Dividiendo ambos lados de la ecuación por -RT da:
| ln K° = | - Δ H°/RT | + | Δ S°/r |
| y = | mx | + | b |
Una parcela de ln K° vs. 1/T se llama parcela de van 't Hoff. La gráfica tiene
\[\text{slope} = -\dfrac{\Delta_{r}H^{\circ}}{R}\left(\dfrac{1}{T}\right) \nonumber \]
y
\[\text{intercept} = \dfrac{\Delta_{r}S^{\circ}}{R} \nonumber \]
Si las concentraciones de reactivos y productos se miden a diversas temperaturas para que se pueda calcular K° a cada temperatura, tanto el cambio de entropía de reacción como el cambio de entalpía se pueden obtener de una gráfica de van't Hoff.
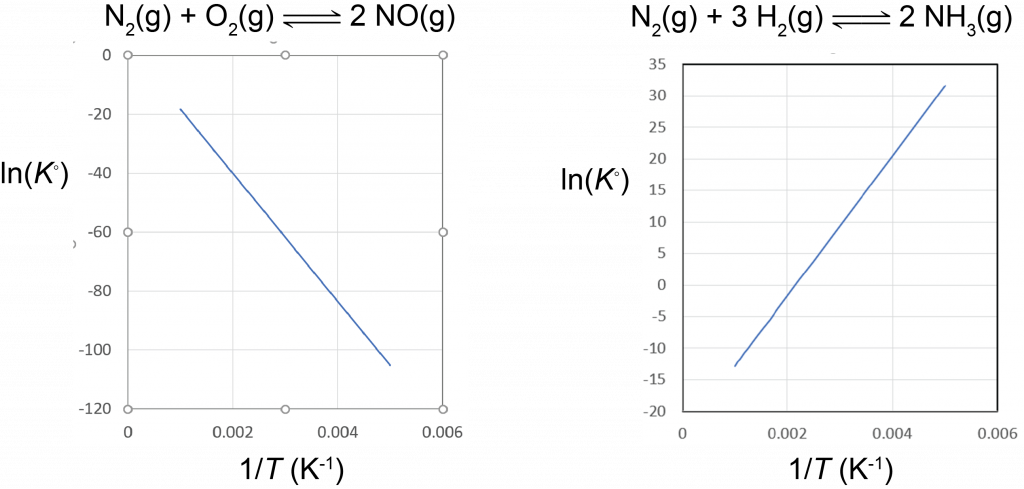 Figura 2. Parcelas de Van 't Hoff. La reacción N 2 + O 2 = 2 NO tiene Δ r H° = 180.5 kJ/mol; para esta reacción endotérmica, a medida que T aumenta (menor 1/T) aumenta la constante de equilibrio. La reacción N 2 + 3 H 2 = 2 NH 3 tiene Δ r H° = −92.2 kJ/mol; para esta reacción exotérmica, a medida que T aumenta (menor 1/T) disminuye la constante de equilibrio.
Figura 2. Parcelas de Van 't Hoff. La reacción N 2 + O 2 = 2 NO tiene Δ r H° = 180.5 kJ/mol; para esta reacción endotérmica, a medida que T aumenta (menor 1/T) aumenta la constante de equilibrio. La reacción N 2 + 3 H 2 = 2 NH 3 tiene Δ r H° = −92.2 kJ/mol; para esta reacción exotérmica, a medida que T aumenta (menor 1/T) disminuye la constante de equilibrio.
Con base en la ecuación para la gráfica de van't Hoff, una reacción exotérmica (Δ r H° < 0) tiene K° decreciente con el aumento de la temperatura, y una reacción endotérmica (Δ r H° > 0) tiene K° aumentando con el aumento de la temperatura. Este resultado cuantitativo concuerda con las predicciones cualitativas realizadas al aplicar el principio de Le Chatelier. También muestra que la magnitud de Δ r H° dicta la rapidez con la que cambia K° en función de la temperatura. En contraste, Δ r S° afecta la magnitud de K° pero no su dependencia de la temperatura.
Por ejemplo, supongamos que K° 1 y K° 2 son las constantes de equilibrio para una reacción a temperaturas T1 y T2, respectivamente:
\[\text{ln}\;K_1^{\circ} = -\dfrac{\Delta_{r}H^{\circ}}{R}\left(\dfrac{1}{T_1}\right)\;+\;\dfrac{\Delta_{r}S^{\circ}}{R} \nonumber \]
\[\text{ln}\;K_2^{\circ} = -\dfrac{\Delta_{r}H^{\circ}}{R}\left(\dfrac{1}{T_2}\right)\;+\;\dfrac{\Delta_{r}S^{\circ}}{R} \nonumber \]
Al restar las dos ecuaciones se obtiene:
\[\begin{array}{rcl} \text{ln}\;\text{K}_2^{\circ}\;-\;\text{ln}\;\text{K}_1^{\circ} &=& \left(-\dfrac{\Delta_{r}H^{\circ}}{R}\left(\dfrac{1}{T_2}\right)\;+\;\dfrac{\Delta_{r}S^{\circ}}{R}\right) - \left(-\dfrac{\Delta_{r}H^{\circ}}{R}\left(\dfrac{1}{T_1}\right)\;+\;\dfrac{\Delta_{r}S^{\circ}}{R}\right)\\[0.5em] \text{ln}\;\dfrac{K_2^{\circ}}{K_1^{\circ}} &=& -\dfrac{\Delta_{r}H^{\circ}}{R}\left(\dfrac{1}{T_2}\;-\;\dfrac{1}{T_1}\right)\\[0.5em] &=& \dfrac{\Delta_{r}H^{\circ}}{R}\left(\dfrac{1}{T_1}\;-\;\dfrac{1}{T_2}\right)\end{array} \nonumber \]
Así, calcular Δ r H° a partir de la tabulación Δ f H° y medir la constante de equilibrio a una temperatura nos permite calcular la constante de equilibrio a cualquier otra temperatura (asumiendo que Δ r H° y Δ r S° son independientes de la temperatura).
Pregunta Podia
El nitrato de amonio es un importante fertilizante que suministra nitrógeno a los cultivos. También se puede utilizar como explosivo para remover tocones de árboles de campos agrícolas o en bombardeos terroristas. Existen dos reacciones que pueden ocurrir para producir el efecto explosivo. A temperaturas más bajas, el nitrato de amonio se descompone para formar monóxido de dinitrógeno y vapor de agua, pero a temperaturas más altas se descompone explosivamente para formar nitrógeno, vapor de agua y oxígeno. Las ecuaciones de reacción y los parámetros termodinámicos a 298 K son
(1) NH 4 NO 3 (s) → N 2 O (g) + 2 H 2 O (g) Δ r H ° = −36.026 kJ/mol Δ r S° = 446.42 J K −1 mol −1
(2) NH 4 NO 3 (s) → N 2 (g) + ½ O 2 (g) + 2 H 2 O (g) Δ r H ° = −118.076 kJ/mol Δ r S° = 520.749 J K −1 mol −1
a) ¿Cuál de las reacciones es (es) favorecida por el producto a temperatura ambiente? ¿Cuál de las reacciones es (son) favorecidas por el producto a 1000 K? Explique brevemente.
b) ¿Hay una temperatura por debajo de la cual una de las reacciones es más favorecida por el producto y por encima de la cual la otra reacción es más favorecida por el producto? Si existe tal temperatura para estas dos reacciones, determine cuál es esa temperatura.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


