4.6: Día 32- Energía y Trabajo Libre de Gibbs, Metástasis Cinética
- Page ID
- 78959
29
Día 32: Energía y Trabajo Libre de Gibbs, Metástasis Cinética
D32.1 Energía y Trabajo Libres de Gibbs
Recordemos que cuando hablamos de cinética de una reacción, nos preocupa la velocidad de la reacción: qué tan rápido pasa de los reactivos a los productos. Cuando hablamos de la termodinámica de una reacción, nos preocupa principalmente la diferencia de energía entre los reactivos y los productos, pero no por el mecanismo por el cual los reactivos se transforman en productos.
Cuando la energía libre de Gibbs de los productos es menor que la de los reactivos, se dice que una reacción es exergónica. Por el contrario, una reacción endergónica es aquella en la que los productos son más altos en energía libre de Gibbs que los reactivos.
Cuando hay una disminución en la energía libre de Gibbs a medida que ocurre una reacción, Δ r G equivale al trabajo útil máximo que puede realizar el sistema de reacción. Δ r G = − w máx. (El signo negativo refleja el hecho de que w se define como el trabajo realizado en el sistema.) Por el contrario, si una reacción tiene Δ r G positiva, se debe trabajar en el sistema para forzar que se produzca la reacción. El trabajo mínimo que se debe realizar viene dado por Δ r G.
Actividad 1: Reacciones exergónicas y Endergónicas
Al considerar una reacción en condiciones de estado estándar, la cantidad termodinámica relevante es Δ r G°. Si una reacción es exergónica en condiciones de estado estándar, Δ r G° < 0.
Reacciones acopladas
Una forma de permitir que ocurra un proceso favorecido por los reactivos es acoplarlo con una reacción favorecida por el producto. Por ejemplo, considere la recuperación de aluminio a partir de mineral de alúmina (Al 2 O 3):
Al 2 O 3 (s) → 2 Al (s) + 3/2 O 2 (g) Δ r G° (298 K) = 1576.4 kJ/mol
Se deben hacer al menos 1576.4 kJ de trabajo para cambiar 1 mol Al 2 O 3 (s) en 2 mol Al (s) y 1.5 mol O 2 (g) (a 1 bar). En una moderna planta de fabricación de aluminio, esta obra se suministra eléctricamente y la electricidad suele ser proporcionada por la quema de carbón. Suponiendo que el carbón es principalmente carbono, la reacción de combustión es:
C (s) + O 2 (g) → CO 2 (g) Δ r G° (298 K) = −394,4 kJ/mol
Así, los valores Δ r G° indican que, bajo condiciones de estado estándar y eficiencia ideal del 100%, al menos cuatro moles de carbono/carbón deben quemar para procesar cada mol de mineral de Al 2 O 3. (En la práctica el proceso de fundición de aluminio es solo 17% eficiente, por lo que es necesario quemar casi 6 veces la cantidad teórica de carbón). Las reacciones acopladas ocurren simultáneamente y existe un medio de intercambio de energía entre ellas. El intercambio de energía se produce a través de la red eléctrica en este caso específico.
En otras palabras, una reacción que es endergónica en condiciones de estado estándar puede acoplarse a una reacción exergónica separada que impulsa a que ocurra la reacción endergónica (la termodinámicamente desfavorable). Los valores de Δ rG ° para las dos reacciones acopladas se suman para producir el Δ r G ° global. Para este ejemplo, multiplicar la segunda reacción por 4, sumar las ecuaciones de reacción, y aplicar la Ley de Hess, da:
Al 2 O 3 (s) + 4 C (s) + 4 O 2 (g) → 2 Al (s) + 3/2 O 2 (g) + 4 CO 2 (g) Δ r G° (298 K) = -1.2 kJ/mol
La reacción global tiene ahora un Δ r G° negativo y está favorecido por el producto.
En condiciones de estado no estándar, una reacción con Δ r G < 0 puede conducir una reacción con Δ r G > 0, siempre que la energía pueda transferirse de una a otra.
D32.2 Energía Libre de Gibbs en Sistemas Biológicos
Los organismos biológicos a menudo acoplan la hidrólisis favorecida por el producto de ATP (trifosfato de adenosina) a una reacción favorecida por el reactivo. Así, la reacción de hidrólisis de ATP puede ser utilizada para impulsar una reacción necesaria, pero termodinámicamente desfavorable.
ATP + H 2 O ADP + H 2 PO 4 — Δ r G° = −30.5 kJ/mol
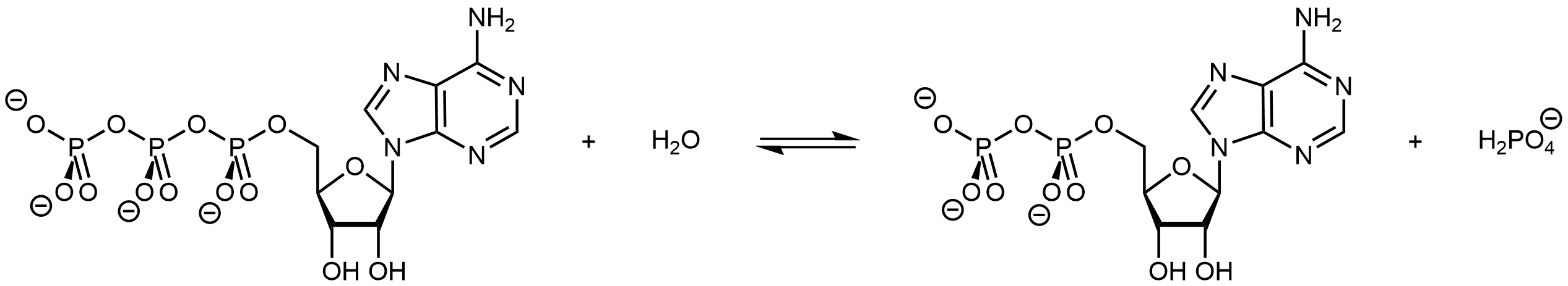
La parte trifosfato del ATP es un éster inorgánico. Se puede formar por reacción de condensación de ADP y H 2 PO 4 — con agua formada como subproducto (el reverso de la reacción mostrada anteriormente). El ATP puede estar disponible en un organismo donde necesita ocurrir una reacción endergónica. Su hidrólisis puede entonces acoplarse con la reacción endergónica para producir una reacción global termodinámicamente favorable.
Por ejemplo, la hidrólisis de ATP se puede usar para conducir reacciones de condensación de aminoácidos para generar proteínas como se ilustra gráficamente en la Figura 1.
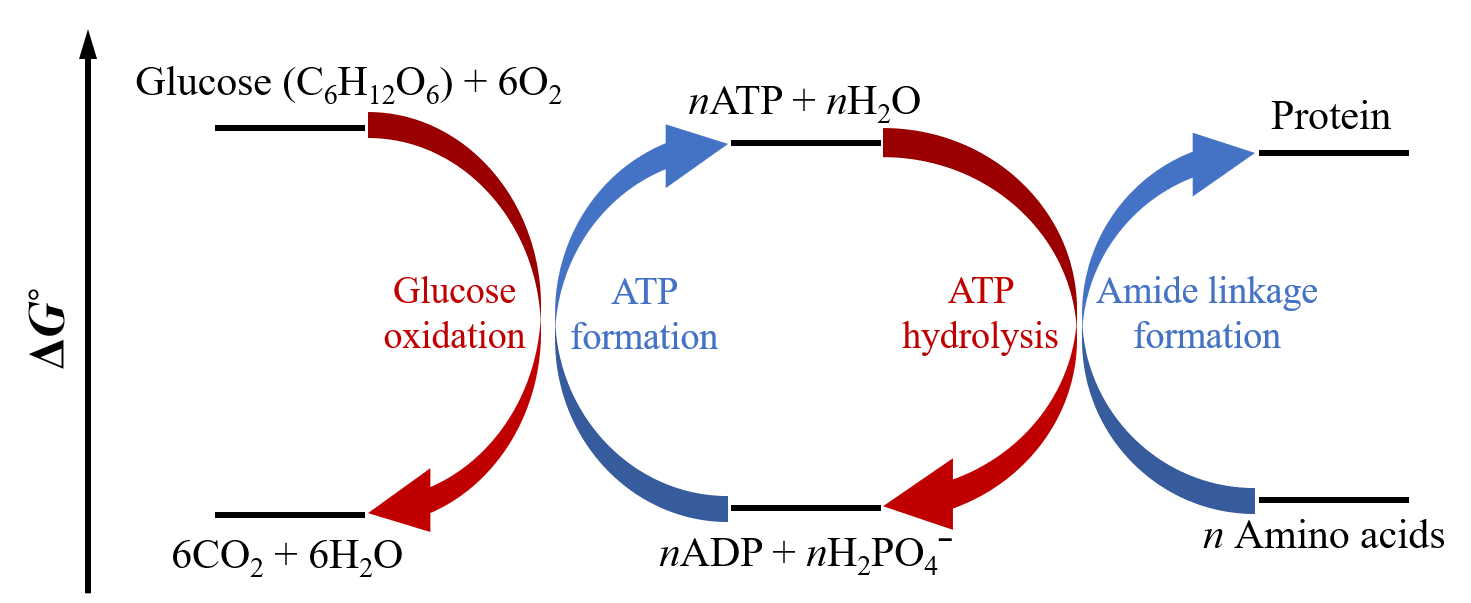
La Figura 1 muestra la formación de ATP inicialmente acoplada a la reacción de oxidación de glucosa:
C 6 H 12 O 6 + 6 O 2 → 6 CO 2 + 6 H 2 O Δ r G ° =−2880 kJ/mol
que tiene cerca de 100 veces mayor capacidad para hacer trabajo que la hidrólisis de un solo ATP. De ahí que el equilibrio para esta reacción favorece tan fuertemente a los productos que una sola flecha se usa típicamente en la ecuación química ya que es esencial irreversible. Puede que no sea sorprendente que la glucosa y todos los azúcares sean moléculas muy energéticas ya que son la principal fuente de energía de por vida.
Metástasis cinética D32.3
A una temperatura dada, la ley de velocidad y la constante de velocidad se pueden usar para determinar la rapidez con la que los reactivos se convierten en productos. La expresión constante de equilibrio y el valor de K°, por otro lado, pueden ser utilizados para determinar las concentraciones de equilibrio de los productos en relación con los reactivos. En otras palabras, la cinética describe qué tan rápido se alcanza el equilibrio, y la termodinámica describe dónde se encuentra el equilibrio. Sin embargo, no hay necesariamente una correlación entre una reacción rápida y una que es favorecida por el producto en equilibrio. Tanto la cinética como la termodinámica son necesarias para caracterizar una reacción química porque una reacción útil suele ser aquella en la que se pueden producir cantidades significativas de productos en poco tiempo.
Por otro lado, muchas veces es cierto que una sustancia es valiosa para algún propósito cuando es estable y no se transforma en alguna otra sustancia. Por ejemplo, el hierro y el acero son útiles para fabricar automóviles y construir edificios precisamente porque son estables. Al discutir el concepto de estabilidad, es útil distinguir entre estabilidad termodinámica y metaestabilidad cinética.
Considere una reacción genérica:
A B Δ r G° < 0
Aquí el producto B tiene menor Δ f G° que el reactivo A de manera que Δ r G° de la reacción directa es negativo. Cuando una reacción favorece productos en equilibrio, decimos que los productos son termodinámicamente estables en relación con los reactivos. En el ejemplo anterior, el producto B es termodinámicamente estable en comparación con el reactivo A. Sin embargo, si la barrera activación-energía (E a) es alta, a una temperatura dada la reacción podría proceder muy lentamente, y el reactivo A se describiría como inerte (no reactivo). Se dice que el compuesto A es cinéticamente metaestable (o cinéticamente estable) en relación con el compuesto B.
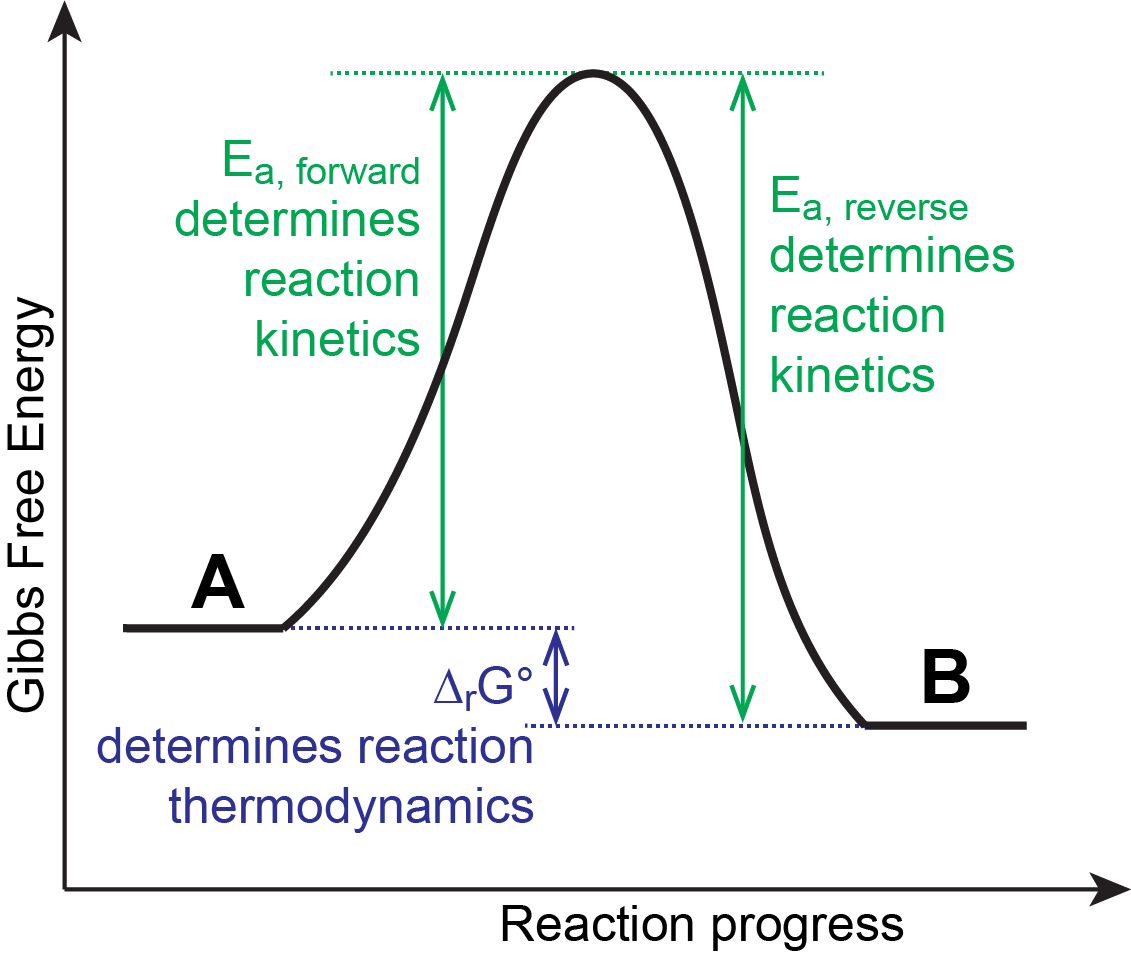
Observe que la estabilidad (y la metaestabilidad) se definen comparando una sustancia con otra. Es posible que alguna otra sustancia, digamos C, sea incluso más estable que B y por lo tanto B sea termodinámicamente inestable en relación con C.
Por ejemplo, el diamante y el grafito son dos compuestos compuestos únicamente por átomos de carbono. El título de una vieja película de James Bond, y un eslogan publicitario aún más antiguo, dice: “Los diamantes son para siempre”. Esto implica cierta estabilidad: no esperamos que el diamante en un anillo cambie pronto.
C (s, diamante) ⟶ C (s, grafito) Δ r G ° = −2.9 kJ/mol
El diamante es cinéticamente metaestable. La termodinámica dice que debería cambiar a grafito, pero el cambio es tan lento que es esencialmente indetectable a las temperaturas del día a día en la vida humana. El hecho de que el diamante exista se debe a una barrera de activación-energía muy grande para la conversión del diamante en grafito; el diamante se convertiría en grafito a temperaturas >4500 K.
Esta E a muy grande, así como los hechos de que el diamante es los sólidos más duros conocidos y el grafito es uno de los más blandos, pueden explicarse por diferencias en la forma en que se enlazan los átomos. En diamante, cada átomo de carbono tiene hibridación sp 3 y cada carbono sp 3 está unido a otros 4 átomos de carbono sp 3 en las esquinas de un tetraedro. En grafito, cada átomo de carbono tiene hibridación sp 2 y cada carbono sp 2 está unido a otros 3 átomos de carbono sp 2 en láminas planas de anillos de benceno conectados. Debido a que las hojas pueden deslizarse unas junto a otras con relativa facilidad, el grafito es suave y resbaladizo.
La conversión de diamante a grafito requiere romper numerosos enlaces simples C−C con una energía de enlace de 356 kJ/mol. No hay un mecanismo fácil para esta conversión y, por lo tanto, transformar el diamante en grafito, o viceversa, requiere casi tanta energía como destruir toda la celosía cristalina y reconstruirla. Por lo tanto, una vez formado el diamante, no puede volver a convertirse en grafito en condiciones normales porque E a es demasiado alto: se dice que el diamante es metaestable porque su estabilidad depende de la cinética, no de la termodinámica.
D32.4 Proceso Haber-Bosch
La interacción de la termodinámica y la cinética se ilustra en la síntesis industrial del amoníaco. Se hizo posible fabricar amoníaco en cantidades útiles a principios del siglo XX después de que se entendieran los factores que influyen en este equilibrio de reacción:
N 2 (g) + 3 H 2 (g) 2 NH 3 (g) Δ r H ° = -92.2 kJ/mol
Cada año, el amoníaco se encuentra entre los 10 mejores productos químicos, en masa, fabricados en el mundo. Desempeña un papel vital en la economía global. Se utiliza en la producción de fertilizantes y es, en sí mismo, un fertilizante importante para potenciar el crecimiento de maíz, algodón y otros cultivos. Grandes cantidades de amoníaco se convierten en ácido nítrico, que juega un papel importante en la producción de fertilizantes, explosivos, plásticos, tintes y fibras, y también se utiliza en la industria siderúrgica.
Para ser práctico, un proceso industrial debe dar un gran rendimiento de producto con relativa rapidez. Una forma de aumentar el rendimiento de amoníaco es aumentar la presión sobre el sistema, lo que desplaza el equilibrio de reacción hacia el lado del producto, aumentando la concentración y presión parcial del amoníaco.
A bajas temperaturas, la tasa de formación de amoníaco es lenta por lo que el equilibrio se lograría más rápidamente a temperaturas más altas. Sin embargo, la reacción es exotérmica. Al aumentar la temperatura para aumentar la velocidad, se desplaza el equilibrio en la dirección endotérmica y se disminuye el rendimiento del producto.
Parte de la velocidad más lenta causada por operar a temperaturas más bajas se puede recuperar usando un catalizador. El efecto neto del catalizador sobre la reacción es hacer que el equilibrio se alcance más rápidamente.
El amoníaco, el producto de reacción, tiene un punto de ebullición mayor que los reactivos, nitrógeno e hidrógeno; así, el amoníaco se puede condensar a un líquido a temperaturas donde N 2 y H 2 permanecen gases. La condensación de amoníaco por refrigeración de la mezcla gaseosa elimina el producto, desplazando el equilibrio hacia la derecha.
Ejercicio 5: Fuerzas intermoleculares y punto de ebullición
El amoníaco tiene un punto de ebullición más alto que el nitrógeno y el hidrógeno debido a las fuerzas intermoleculares.
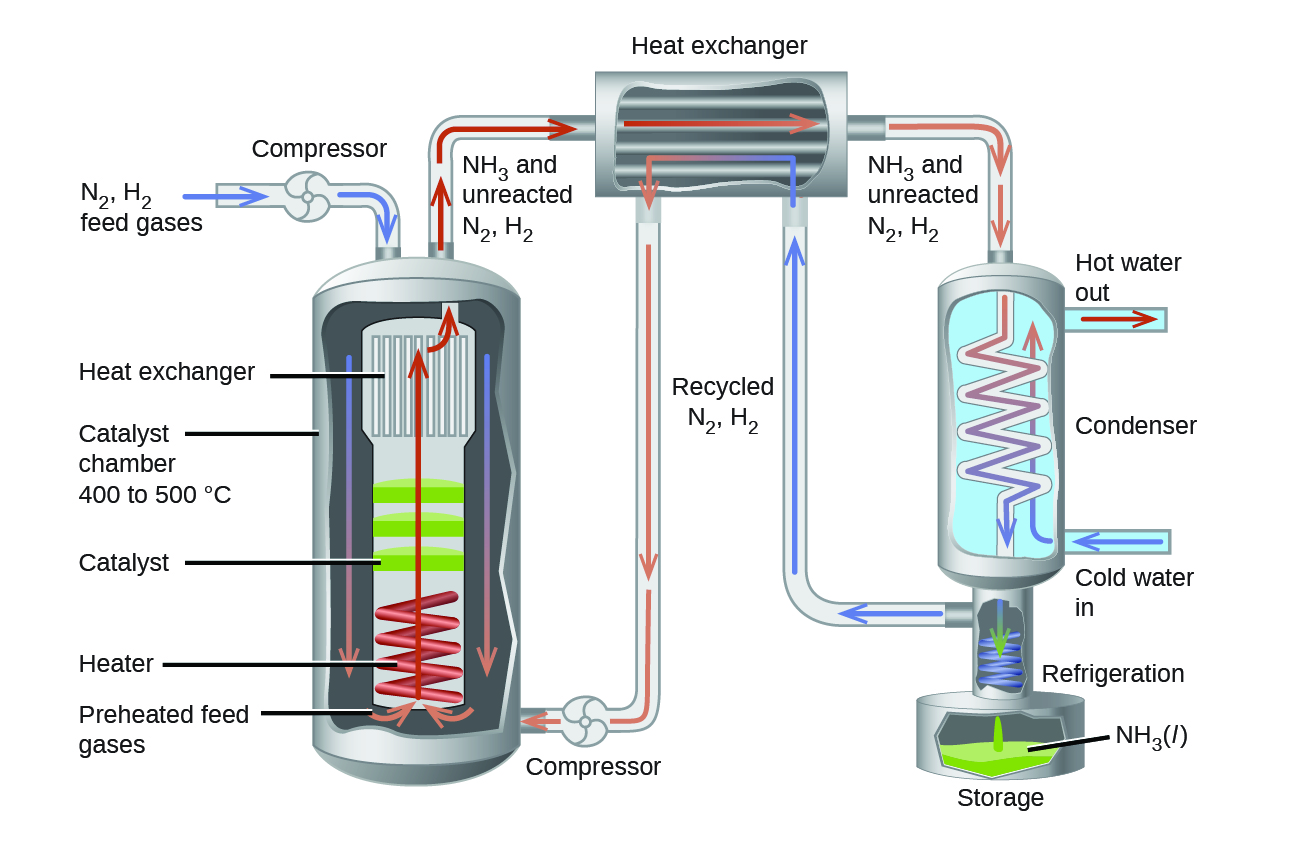
En la producción comercial de amoníaco, las condiciones suelen ser de 400 a 500 °C y de 150 a 250 bar. El catalizador consiste en Fe 3 O 4 mezclado con KOH, Al 2 O 3 y SiO 2. Esto da el mejor compromiso entre la tasa, el rendimiento del producto y el costo del equipo necesario para producir y contener gases de alta presión a altas temperaturas (Figura 3).
Pregunta Podia
Considera la adición de HBr al 1,3-butadieno. Dos productos son posibles: 1,2-producto y 1,4-producto (ver lado izquierdo de la figura). 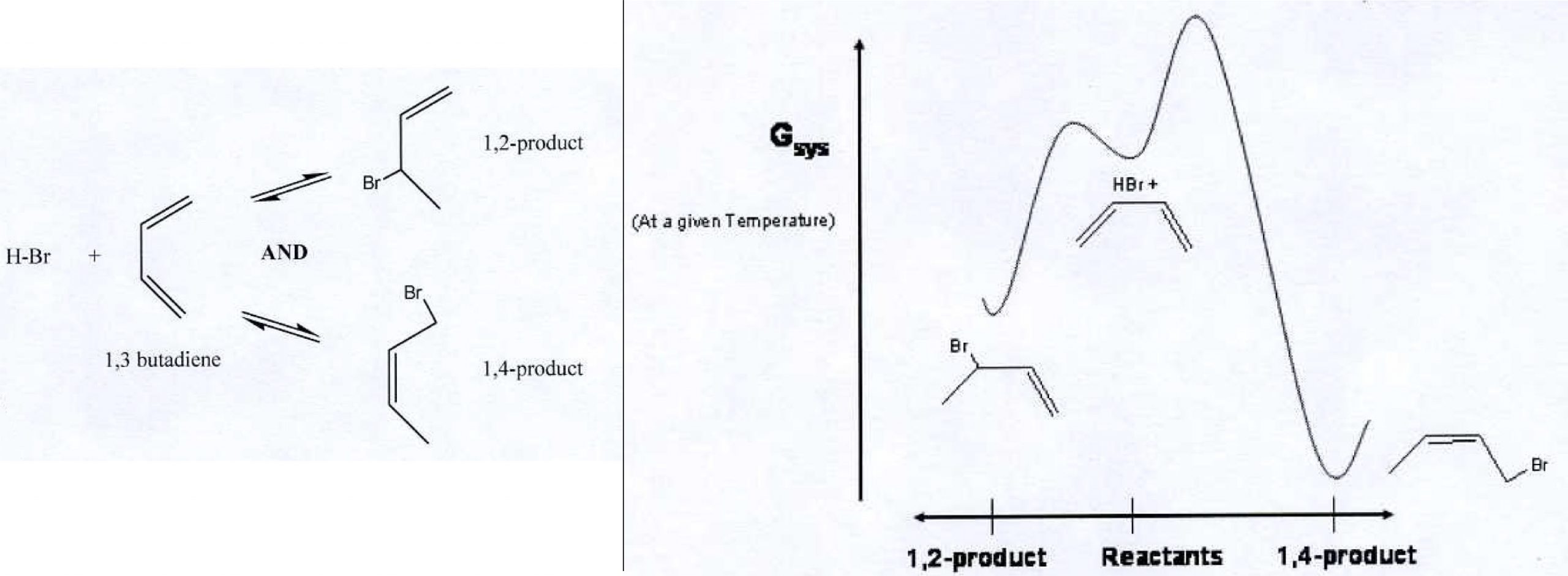
En el lado derecho de la figura hay un diagrama que muestra la energía libre de Gibbs en función del progreso de la reacción. En el eje horizontal los reactivos están en el medio. El 1,2-producto se alcanza moviéndose a la izquierda. El 1,4-producto se alcanza moviéndose a la derecha.
1. Escribir una explicación en lenguaje científicamente apropiado para el hecho de que a temperaturas más bajas la reacción produce principalmente 1,2-producto mientras que a temperaturas más altas la reacción produce principalmente 1,4-producto. Si es necesario hacer alguna suposición, diga cuáles son.
2. Un estudiante dice que a temperaturas más bajas el 1,2-producto es cinéticamente metaestable comparado con el 1,4-producto. ¿Es esta una afirmación correcta? ¿Por qué o por qué no?
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


