5.3: Día 38- Reacciones de oxidación-reducción, células fotovoltaicas
- Page ID
- 78907
34
Día 38: Reacciones de oxidación-reducción, células voltáicas
D38.1 Reacciones de oxidación-reducción y electroquímica
La electroquímica se ocupa de las reacciones químicas que implican transferencia de densidad electrónica; en otras palabras, las reacciones producen electricidad o son causadas por el paso de corriente eléctrica a través de la materia. Estas reacciones se denominan reacciones de oxidación-reducción (abreviado redox).
Aquí hay una breve lista de unidades y definiciones utilizadas cuando se discuten las reacciones redox y sus aplicaciones.
- La unidad SI de carga eléctrica es el culombo, C.
- La unidad elemental de carga es la carga de un solo electrón, que es igual a 1.602 × 10 −19 C.
- El movimiento de electrones (o iones) transporta cargas eléctricas de un lugar a otro, y la cantidad de dicha carga transferida por unidad de tiempo es la corriente eléctrica.
- La corriente tiene el amperio unitario SI, A, que es la transferencia de un culombio por segundo (1 A = 1 C/s).
- Por lo general, la corriente eléctrica fluye en un camino cerrado, llamado circuito eléctrico.
- Es necesario mantener un circuito cerrado para que la corriente fluya. Si el circuito está abierto, la corriente no fluirá.
- El potencial eléctrico, voltaje de unidad SI, V, es la capacidad de un campo eléctrico para realizar trabajos en una carga.
- Un flujo de carga es causado por una diferencia de potencial eléctrico entre dos puntos en el circuito.
- Cuando 1 culombo de carga se mueve a través de una diferencia de potencial de 1 voltio, gana o pierde 1 julio de energía (1 J = 1 C × 1 V).
- La energía eléctrica es la cantidad de energía transferida por unidad de tiempo y se mide en vatios, W (1 W = 1 J/1 s).
D38.2 Reacciones Redox y Número de Oxidación
Algunas reacciones redox implican la transferencia de electrones entre los átomos reactivos para producir productos iónicos. Por ejemplo, la formación de una red cristalina de cloruro de sodio (una red de iones Na + e iones Cl −) requiere la transferencia de electrones de átomos de sodio a átomos de cloro:
2Na (s) + Cl 2 (g) ⟶ 2NaCl (s)
Es útil considerar la transferencia de electrones como dos procesos concurrentes. A los procesos se les llama medias reacciones, una en la que se pierden electrones y otra en la que se ganan electrones. Las medias reacciones para la reacción de sodio con cloro son:
| 2Na (s) | ⟶ | 2Na + (s) + 2e − |
| Cl 2 (g) + 2e − | ⟶ | 2Cl − (s) |
Las medias reacciones nos permiten ver que el número de electrones perdidos es igual al número de electrones ganados—no podemos crear ni destruir electrones en una reacción química. Las medias reacciones también muestran qué especies ganan electrones (átomos de Cl en Cl 2) y qué especies pierden electrones (átomos de Na). Se dice que la especie que pierde electrones está oxidada y la pérdida de electrones se llama oxidación; se dice que la especie que gana electrones se reduce y la ganancia de electrones se llama reducción.
La especie que provoca que se produzca la reducción se denomina agente reductor (o reductor). En esta reacción el sodio es el agente reductor porque provoca que Cl 2 gane electrones. La especie que provoca la oxidación se llama agente oxidante (u oxidante). En esta reacción el cloro funciona como oxidante, provocando que el sodio pierda electrones.
Algunos procesos redox no implican transferencia obvia de electrones porque no hay iones involucrados en la reacción. Por ejemplo:
H 2 (g) + Cl 2 (g) ⟶ 2HCl (g)
Para clasificar sistemáticamente las reacciones redox de todos los tipos, definimos el número de oxidación (o estado de oxidación) de un elemento en un compuesto como la carga que poseerían sus átomos si el compuesto fuera iónico, es decir, si todos los electrones en cada enlace covalente polar fueran asignados al átomo más electronegativo.
Los siguientes pasos se pueden usar para asignar números de oxidación a cada elemento en un compuesto.
- El número de oxidación de un átomo en una sustancia elemental es cero.
- El número de oxidación de un ion monoatómico es igual a la carga del ion.
- La suma de los números de oxidación sobre todos los átomos en un compuesto neutro es cero.
- La suma de los números de oxidación sobre todos los átomos en un ion poliatómico es igual a la carga del ion. Si un compuesto incluye más de un ion poliatómico, el número de oxidación de un átomo en un ion puede diferir del número de oxidación en el otro ion poliatómico.
- Los átomos de algunos elementos tienen el mismo número de oxidación en casi todos los compuestos.
- El flúor siempre tiene un número de oxidación -1 cuando está presente en un compuesto
- Los átomos de metales alcalinos (Li, Na, K, Rb, Cs) tienen un número de oxidación +1 en casi todos los compuestos
- Los átomos de metales alcalinotérreos (Be, Mg, Ca, Sr, Ba) tienen un número de oxidación +2 en casi todos los compuestos
- El hidrógeno tiene un número de oxidación +1 cuando se combina con no metales, −1 cuando se combina con metales
- Aplicar estas dos reglas solo si las reglas 1-5 no han determinado todos los números de oxidación.
- El oxígeno tiene número de oxidación −2 a menos que las reglas 1-5 ya hayan dado a O un número de oxidación diferente
- En compuestos binarios de no metales, al elemento más electronegativo se le da un número de oxidación negativo igual a la carga en su ión monoatómico; por ejemplo en PCl 3, a más Cl electronegativo se le asigna el número de oxidación −1 y P se le asigna +3 (por regla 3).
Actividad 1
Usando números de oxidación podemos identificar reacciones redox buscando uno o más elementos cuyos números de oxidación cambian durante el transcurso de la reacción. Cuando su número de oxidación aumenta, un elemento se ha oxidado; cuando su número de oxidación disminuye, el elemento se ha reducido.
En esta reacción
2 Na (s) + Cl 2 (g) ⟶ 2 NaCl (s)
el sodio se oxida (su número de oxidación aumenta de 0 en Na a +1 en NaCl) y el cloro se reduce (su número de oxidación disminuye de 0 en Cl 2 a -1 en NaCl).
En esta reacción
H 2 (g) + Cl 2 (g) ⟶ 2 HCl (g)
el hidrógeno se oxida (su número de oxidación aumenta de 0 en H 2 a +1 en HCl) y el cloro se reduce (su número de oxidación disminuye de 0 en Cl 2 a -1 en HCl).
Se pueden identificar varias subclases de reacciones redox. Un ejemplo son las reacciones de combustión en las que el reductor (combustible) y el oxidante (a menudo, O 2) reaccionan vigorosamente y producen un aumento significativo de la temperatura, a menudo en forma de llama. Otra clase de reacción redox es una reacción de propulsor de cohetes como esta en la que el aluminio sólido es oxidado por perclorato amónico:
10 Al (s) + 6 NH 4 ClO 4 (s) ⟶ 4 Al 2 O 3 (s) + 2 AlCl 3 (s) + 12 H 2 O (g) + 3 N 2 (g)
Ejercicio 4: Reconocer los agentes oxidantes y reductores
Para la reacción a continuación, identificar qué especies se oxidan y cuáles se reducen, e identificar el agente oxidante y el agente reductor.
8 H + (aq) + MnO 4 — (aq) + 5 Fe 2 + (aq) → 5 Fe 3 + (aq) + Mn 2 + (aq) + 4 H 2 O (l)
[Ingresa tus respuestas sin subíndices, superíndices o estados, y pon cargos entre paréntesis. Por ejemplo, SO 4 2 - (aq) se ingresaría como SO4 (2-).]
D38.3 Equilibrio de reacciones redox
Las reacciones redox ocurren frecuentemente en soluciones acuosas, que pueden ser ácidas, básicas o neutras. Además, las moléculas de H 2 O pueden participar activamente en la reacción, y dependiendo de las condiciones, H 3 O + (presente en condiciones ácidas) y OH − (presente en condiciones básicas) también pueden ser un reactivo o un producto.
Las medias reacciones facilitan el equilibrio de las reacciones redox porque se puede equilibrar la semireacción de oxidación por separado de la media reacción de reducción, y asegurarse de que el número de electrones perdidos en el proceso de oxidación sea igual al número de electrones obtenidos en el proceso de reducción.
Equilibraremos un ejemplo de reacción redox en solución ácida y otra en solución básica para ilustrar el proceso de equilibrio de reacciones redox, y resaltar cómo la naturaleza de la solución puede desempeñar un papel. (Una solución neutra puede tratarse como ácida o básica, aunque tratarla como ácida suele ser más fácil).
Solución ácida
Considere la reacción desequilibrada:
MnO 4 (aq) + Fe 2 + (aq) ⟶ Mn 2 + (aq) + Fe 3 + (aq)
donde el hierro sufrió oxidación porque Fe 2 + ha perdido un electrón para convertirse en Fe 3 +, y el manganeso sufrió reducción porque ganó cinco electrones para cambiar de un estado de oxidación de +7 a un estado de oxidación de +2.
| Oxidación (desequilibrada): | Fe 2 + (aq) | ⟶ | Fe 3 + (aq) |
| Reducción (desequilibrada): | MnO 4 (aq) | ⟶ | Mn 2 + (aq) |
Para las reacciones redox, es una simplificación útil representar H 3 O + (aq) como H + (aq) —donde existe la necesidad de equilibrar los átomos de O, podemos involucrar H 2 O (l), y luego usar H + (aq) para equilibrar los átomos de H.
Por ejemplo, en la media reacción de reducción anterior, hay cuatro átomos de O en el lado izquierdo y ninguno en el lado derecho. Para equilibrar los elementos, podemos agregar 4 H 2 O (l) al lado del producto, y luego para equilibrar los átomos de H, agregar 8 H + (aq) al lado reactivo:
Reducción (carga no balanceada): MnO 4 − (aq) + 8H + (aq) ⟶ Mn 2 + (aq) + 4H 2 O (l)
Una vez que los átomos han sido equilibrados, necesitamos equilibrar la carga eléctrica para cada media reacción. Para la semi-reacción de oxidación, la carga total en el lado izquierdo es +2 y la carga total en el lado derecho es +3, por lo que la carga está desequilibrada. Utilizamos electrones para equilibrar la carga. La adición de un solo electrón en el lado derecho da una semireacción de oxidación equilibrada:
Oxidación (equilibrada): Fe 2 + (aq) ⟶ Fe 3 + (aq) + e
En las medias reacciones de oxidación, los electrones aparecen en el lado derecho de la ecuación. Debido a que el hierro se oxida, el hierro es el agente reductor en esta reacción redox.
Siempre debes verificar que la media reacción esté equilibrada para el número de átomos de cada elemento y la carga total:
| Fe: | (1 átomo en Fe 2 +) · (1 Fe 2 +) = 1 | ⟶ | (1 átomo en Fe 3 +) · (1 Fe 3 +) = 1 | 1 = 1 ✓ |
| Cargar: | 1· (+2) = +2 | ⟶ | 1· (+3) + 1· (-1) = +2 | +2 = +2 ✓ |
Si los átomos y las cargas están equilibrados, entonces la media reacción en sí está equilibrada.
Para la media reacción de reducción, hemos equilibrado los átomos pero no la carga. La carga total en el lado reactivo es +7, la carga total en el lado producto es +2. Por lo tanto, es necesario agregar cinco electrones al lado izquierdo para lograr el equilibrio de carga:
Reducción (balanceada): MnO 4 − (aq) + 8H + (aq) + 5e − ⟶ Mn 2 + (aq) + 4H 2 O (l)
En todas las medias reacciones de reducción, los electrones aparecen en el lado izquierdo. La especie que se redujo, MnO 4 −, es el agente oxidante en esta reacción redox.
Nuevamente, verifique que la media reacción esté equilibrada para el número de átomos de cada elemento y la carga total:
| Mn: | (1 átomo en MnO 4 −) · (1 MnO 4 −) = 1 | ⟶ | (1 átomo en Mn 2 +) · (1 Mn 2 +) = 1 | 1 = 1 ✓ |
| O: | (4 átomos en MnO 4 −) · (1 MnO 4 −) = 4 | ⟶ | (1 átomo en H 2 O) · (4 H 2 O) = 4 | 4 = 4 ✓ |
| H: | (1 átomo en H +) · (8 H +) = 8 | ⟶ | (2 átomos en H 2 O) · (4 H 2 O) = 8 | 8 = 8 ✓ |
| Cargar: | 1· (-1) + 8· (+1) + 5· (-1) = +2 | ⟶ | 1· (+2) + 4· (0) = +2 | +2 = +2 ✓ |
Ahora tenemos dos medias reacciones equilibradas:
| Oxidación: | Fe 2 + (aq) | ⟶ | Fe 3 + (aq) + e |
| Reducción: | MnO 4 − (aq) + 8H + (aq) + 5e − | ⟶ | Mn 2 + (aq) + 4H 2 O (l) |
La clave para combinar las medias reacciones son los electrones: el número de electrones generados por la semirreacción de oxidación debe ser igual al número de electrones consumidos por la semirreacción de reducción. Aquí, la semi-reacción de oxidación genera un electrón, mientras que la media reacción de reducción requiere cinco. El múltiplo común más bajo de uno y cinco es cinco. Por lo tanto, es necesario multiplicar primero la semirreacción de oxidación por cinco y la semirreacción de reducción por uno, luego sumar las medias reacciones resultantes:
| Oxidación: | 5 × (Fe 2 + (aq) | ⟶ | Fe 3 + (aq) + e) |
| Reducción: | MnO 4 − (aq) + 8 H + (aq) + 5e − | ⟶ | Mn 2 + (aq) + 4 H 2 O (l) |
| en general: | 5 Fe 2 + (aq) + MnO 4 − (aq) + 8 H + (aq) | ⟶ | 5 Fe 3 + (aq) + Mn 2 + (aq) + 4 H 2 O (l) |
Esta es la ecuación equilibrada global en solución ácida. Los electrones no aparecen en la ecuación general de reacción porque todos los electrones perdidos en la semireacción de oxidación se ganan en la media reacción de reducción. A cada lado de la ecuación general debe haber el mismo número de átomos de cada elemento y la misma carga eléctrica total. Asegúrese de revisar cuidadosamente cada lado para verificar que todo se haya equilibrado correctamente.
Solución Básica
La forma más sencilla de equilibrar la reacción redox en solución básica es comenzar con la ecuación equilibrada en solución ácida, luego “convertir” H + (aq) a OH − (aq) (hay un exceso de iones OH − en lugar de iones H 3 O + en soluciones básicas). Por ejemplo, al equilibrar la siguiente reacción en solución básica:
MnO 4 − (aq) + Cr (OH) 3 (s) ⟶ MnO 2 (s) + CrO 4 2 - (aq)
comenzar recolectando las especies dadas en semireacciones de oxidación y reducción desequilibradas:
| Oxidación (desequilibrada): | Cr (OH) 3 (s) | ⟶ | CrO 4 2 - (aq) |
| Reducción (desequilibrada): | MnO 4 (aq) | ⟶ | MnO 2 (s) |
Para la semi-reacción de oxidación, podemos agregar una molécula H 2 O al lado izquierdo para equilibrar los átomos de oxígeno, y luego equilibrar los átomos de hidrógeno con cinco H + (aq) en el lado derecho (nuevamente, hacemos el equilibrio inicial asumiendo solución ácida):
Oxidación (carga no balanceada): Cr (OH) 3 (s) + H 2 O (l) ⟶ CrO 4 2 - (aq) + 5H + (aq)
El lado izquierdo de la ecuación tiene una carga total de 0, y el lado derecho una carga total de +3. La adición de tres electrones al lado derecho produce una semi-reacción de oxidación equilibrada en masa y carga (en solución ácida):
Oxidación (balanceada): Cr (OH) 3 (s) + H 2 O (l) ⟶ CrO 4 2 - (aq) + 5H + (aq) + 3e
Comprobando la media reacción:
| Cr: | (1 átomo en Cr (OH) 3) · (1 Cr (OH) 3) = 1 | ⟶ | (1 átomo en CrO 4 2 -) · (1 CrO 4 2 -) = 1 | 1 = 1 ✓ |
| O: | (3 átomos en Cr (OH) 3) · (1 Cr (OH) 3) + (1 átomo en H 2 O) · (1 H 2 O) = 4 | ⟶ | (4 átomos en CrO 4 2 -) · (1 CrO 4 2 -) = 4 | 4 = 4 ✓ |
| H: | (3 átomos en Cr (OH) 3) · (1 Cr (OH) 3) + (2 átomos en H 2 O) · (1 H 2 O) = 5 | ⟶ | (1 átomo en H +) · (5 H +) = 5 | 5 = 5 ✓ |
| Cargar: | 1· (0) + 1· (0) = 0 | ⟶ | 1· (-2) + 5· (+1) + 3· (-1) = 0 | 0 = 0 ✓ |
Para la media reacción de reducción, necesitamos dos moléculas de H 2 O a la derecha para equilibrar los átomos de oxígeno. Luego para equilibrar los átomos de hidrógeno, necesitamos agregar cuatro H + (aq) a la izquierda:
Reducción (carga no balanceada): MnO 4 — (aq) + 4H + (aq) ⟶ MnO 2 (s) + 2H 2 O (l)
Luego agrega tres electrones al lado izquierdo para equilibrar la carga:
Reducción (balanceada): MnO 4 — (aq) + 4H + (aq) + 3e⟶ MnO 2 (s) + 2H 2 O (l)
Asegúrese de verificar la media reacción:
| Mn: | (1 átomo en MnO 4 —) · (1 MnO 4 —) = 1 | ⟶ | (1 átomo en MnO 2) · (1 MnO 2) = 1 | 1 = 1 ✓ |
| O: | (4 átomos en MnO 4 —) · (1 MnO 4 —) = 4 | ⟶ | (2 átomos en MnO 2) · (1 MnO 2) + (1 átomo en H 2 O) · (2 H 2 O) = 4 | 4 = 4 ✓ |
| H: | (1 átomo en H +) · (4 H +) = 4 | ⟶ | (2 átomos en H 2 O) · (2 H 2 O) = 4 | 4 = 4 ✓ |
| Cargar: | 1· (-1) + 4· (+1) + 3· (-1) = 0 | ⟶ | 1· (0) + 2· (0) = 0 | 0 = 0 ✓ |
Recogiendo lo que tenemos hasta el momento:
| Oxidación: | Cr (OH) 3 (s) + H 2 O (l) | ⟶ | CrO 4 2 - (aq) + 5H + (aq) + 3e |
| Reducción: | MnO 4 — (aq) + 4H + (aq) + 3e | ⟶ | MnO 2 (s) + 2H 2 O (l) |
En este caso, ambas medias reacciones involucran el mismo número de electrones, y por lo tanto podemos simplemente sumar las dos medias reacciones y simplificar:
| Cr (OH) 3 (s) + H 2 O (l) + MnO 4 — (aq) + 4 H + (aq) + 3 e | ⟶ | CrO 4 2 - (aq) + 5 H + (aq) + 3 e+ MnO 2 (s) + 2 H 2 O (l) |
| Cr (OH) 3 (s) + MnO 4 — (aq) | ⟶ | CrO 4 2 - (aq) + H + (aq) + MnO 2 (s) + H 2 O (l) |
Esta es la ecuación redox equilibrada en una solución ácida. Para “convertir” a solución básica, agregue OH − (aq) a ambos lados de la ecuación para “reaccionar” con todo el H + (aq). Esto convierte H + (aq) a H 2 O (l) en un lado y agrega OH − (aq) en el otro lado:
| Cr (OH) 3 (s) + MnO 4 — (aq) + OH − (aq) | ⟶ | CrO 4 2 - (aq) + H + (aq) + OH − (aq) + MnO 2 (s) + H 2 O (l) |
| Cr (OH) 3 (s) + MnO 4 — (aq) + OH − (aq) | ⟶ | CrO 4 2 - (aq) + MnO 2 (s) + 2H 2 O (l) |
Esta es la ecuación equilibrada en solución básica. Comprobando cada lado de la ecuación:
| Cr: | (1 átomo en Cr (OH) 3) · (1 Cr (OH) 3) = 1 | ⟶ | (1 átomo en CrO 4 2 -) · (1 CrO 4 2 -) = 1 | 1 = 1 ✓ |
| Mn: | (1 átomo en MnO 4 —) · (1 MnO 4 —) = 1 | ⟶ | (1 átomo en MnO 2) · (1 MnO 2) = 1 | 1 = 1 ✓ |
| O: | (3 en Cr (OH) 3) · (1) + (4 en MnO 4 —) · (1) + (1 en OH —) · (1) = 8 | ⟶ | (4in CrO 4 2 -) · (1) + (2 en MnO 2) · (1) + (1 en H 2 O) · (2) = 8 | 8 = 8 ✓ |
| H: | (3 en Cr (OH) 3) · (1) + (1 en OH —) · (1) = 4 | ⟶ | (2 átomos en H 2 O) · (2 H 2 O) = 4 | 4 = 4 ✓ |
| Cargar: | 1· (0) + 1· (-1) + 1· (-1) = -2 | ⟶ | 1· (-2) + 1· (0) + 2· (0) = -2 | -2 = -2 ✓ |
D38.4 Introducción a las Celdas Voltáicas
Una celda voltaica (o celda galvánica) es una celda electroquímica en la que una reacción redox espontánea produce una corriente eléctrica. Considera lo que sucede cuando se coloca una pieza limpia de cobre metálico en una solución de nitrato de plata.
https://mediaspace.wisc.edu/id/0_qbq3mm6s
Cuando el metal cobre entra en contacto con la solución de nitrato de plata, el metal plateado comienza a formarse en la superficie del cobre y los iones Cu 2 + pasan a la solución (indicado por el color azul-verde de la solución). La ecuación iónica neta para la reacción es:
Cu (s) + 2 Ag + (aq) ⟶ Cu 2 + (aq) + 2 Ag (s)
que puede dividirse en sus dos medias reacciones que se suman a la reacción general:
| Oxidación: | Cu (s) | ⟶ | Cu 2 + (aq) + 2 e |
| Reducción: | 2 Ag + (aq) + 2 e | ⟶ | 2 Ag (s) |
Las medias reacciones dejan claro que dos electrones son transferidos desde un átomo de cobre, el cual forma un ion Cu 2 +. Cada uno de los dos electrones se transfiere luego a un ion Ag +, que forma un átomo de plata. Debido a que un flujo de electrones constituye una corriente eléctrica, esta transferencia de electrones puede generar una corriente eléctrica si diseñamos una manera de llevar a cabo las dos medias reacciones en recipientes separados y conectarlos con un cable metálico (eléctricamente conductor). Así es en esencia como se diseña una célula voltaica. La Figura 1 muestra una manera de hacerlo.
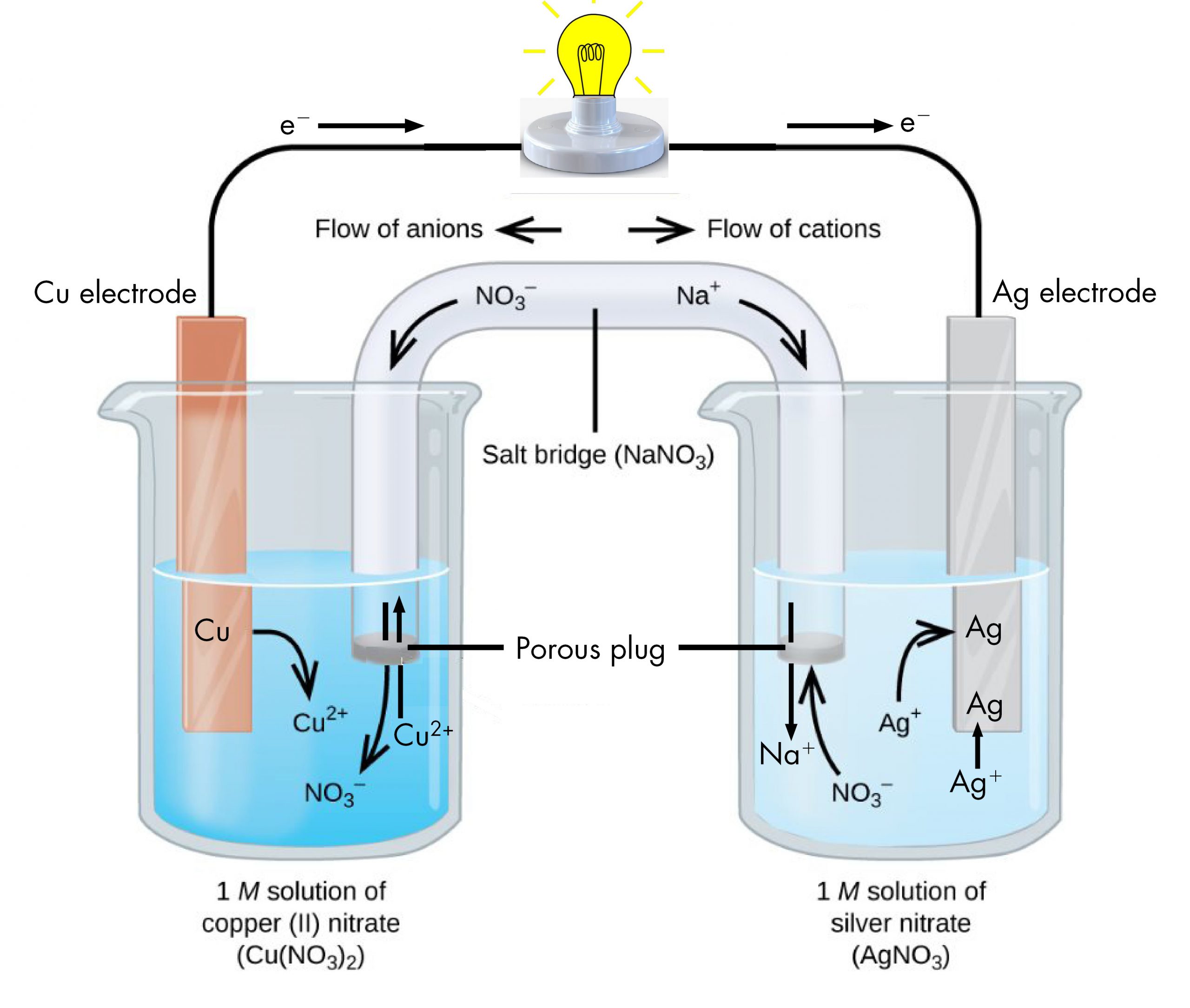
El vaso de precipitados de la izquierda contiene una solución 1-M de nitrato de cobre (II) [Cu (NO 3) 2] con una tira de cobre metálico parcialmente sumergida en la solución. La tira de cobre es un electrodo, un medio para conducir electrones dentro o fuera de la solución. En la superficie de la tira de cobre, se produce la semi-reacción de oxidación:
Cu (s) ⟶ Cu 2 + (aq) + 2 e
El flujo de electrones (corriente eléctrica) sale de la solución a través de la tira de cobre, fluye a través de la bombilla y se mueve hacia la tira plateada en el vaso de precipitados de la derecha. En el vaso derecho, la semi-reacción de reducción ocurre cerca de la superficie de la tira de plata:
2Ag + (aq) + 2 e⟶ 2Ag (s)
Así, con las dos medias reacciones que ocurren en vasos de precipitados separados, se puede generar una corriente eléctrica. El contenedor en el que ocurre cada media reacción se llama media celda.
Si esto fuera todo lo que pasaba, la corriente eléctrica no fluiría por mucho tiempo. En el vaso izquierdo, se agrega un ion Cu 2 + a la solución por cada dos electrones conducidos al cable externo. Esto significa que la solución está acumulando continuamente exceso de iones positivos a medida que ocurre la reacción y se está acumulando una carga eléctrica. Tal acumulación de carga evitaría que se produjera una reacción de oxidación adicional. Esto se puede mitigar si algunos iones positivos se mueven fuera del vaso de precipitados o algunos iones negativos se mueven hacia el vaso de precipitados. Un problema similar está ocurriendo en el vaso derecho, donde los iones Ag + se están eliminando de la solución. Equilibrar las cargas iónicas totales requiere que los iones negativos se muevan fuera de la solución de la derecha o los iones positivos entren.
Este equilibrio de las cargas de iones en las dos medias reacciones separadas se mantiene mediante el puente salino, una solución de una sal que no se mezcla con ninguna solución de media celda sino que permite que los iones pasen dentro o fuera de las semiceldas. Al permitir que los iones conduzcan la carga dentro o fuera de las medias celdas, el puente de sal completa el circuito eléctrico que involucra las dos medias celdas. Sin ella, la corriente no puede fluir por más de un instante. Observe que los iones negativos en el puente de sal se mueven en la misma dirección que los electrones alrededor del circuito y los iones positivos se mueven en la dirección opuesta.
La semicelda en la que se produce la oxidación se llama ánodo. La semicelda en la que se produce la reducción se llama cátodo. Es fácil recordar que el nodo a implica o xidación porque ambas palabras comienzan con vocales. Es fácil recordar que el c atodo implica r educación porque ambas palabras comienzan con consonantes. Estas definiciones, ánodo/oxidación y cátodo/reducción, son ciertas para cualquier celda electroquímica, no solo para una celda voltaica.
Pregunta Podia
Haga un diagrama de una celda voltaica que genere corriente eléctrica a partir de esta reacción química favorecida por el producto:
Fe (s) + Cu (NO 3) 2 (aq) → Fe (NO 3) 2 (aq) + Cu (s)
Elija una solución salina adecuada para el puente salino. Asegúrese de que la media reacción de oxidación esté en el vaso de precipitados izquierdo. Etiquete cada electrodo con un símbolo de elemento. Marque la semicelda del ánodo y la semicelda del cátodo. Etiquetar la dirección de movimiento de electrones, iones positivos e iones negativos en el circuito eléctrico.
A medida que esta celda voltaica opera, un electrodo gana masa y un electrodo pierde masa. Identificar qué electrodo gana masa. Explique por qué ese electrodo gana masa y por qué el otro electrodo pierde masa.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


