5.4: Día 39- Células Voltáicas, Potenciales de Media Celda
- Page ID
- 78908
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)35
Día 39: Células Voltáicas, Potenciales de Media Celda
Potencial de celda voltaica D39.1
Cuando una celda voltaica se conecta a una carga, como una bombilla, fluye una corriente eléctrica porque hay una diferencia en el potencial eléctrico entre los dos electrodos. Esa diferencia de potencial eléctrico se puede medir con un potenciómetro (es decir, un voltímetro). Para una medición precisa, el voltímetro debe tener una resistencia muy alta para que no fluya corriente; de lo contrario el voltaje caería de su valor más alto posible.
La célula voltaica mostrada en la Figura 1, implica la reacción espontánea
Cu (s) + 2 Ag + (aq) ⟶ Cu 2 + (aq) + 2 Ag (s)
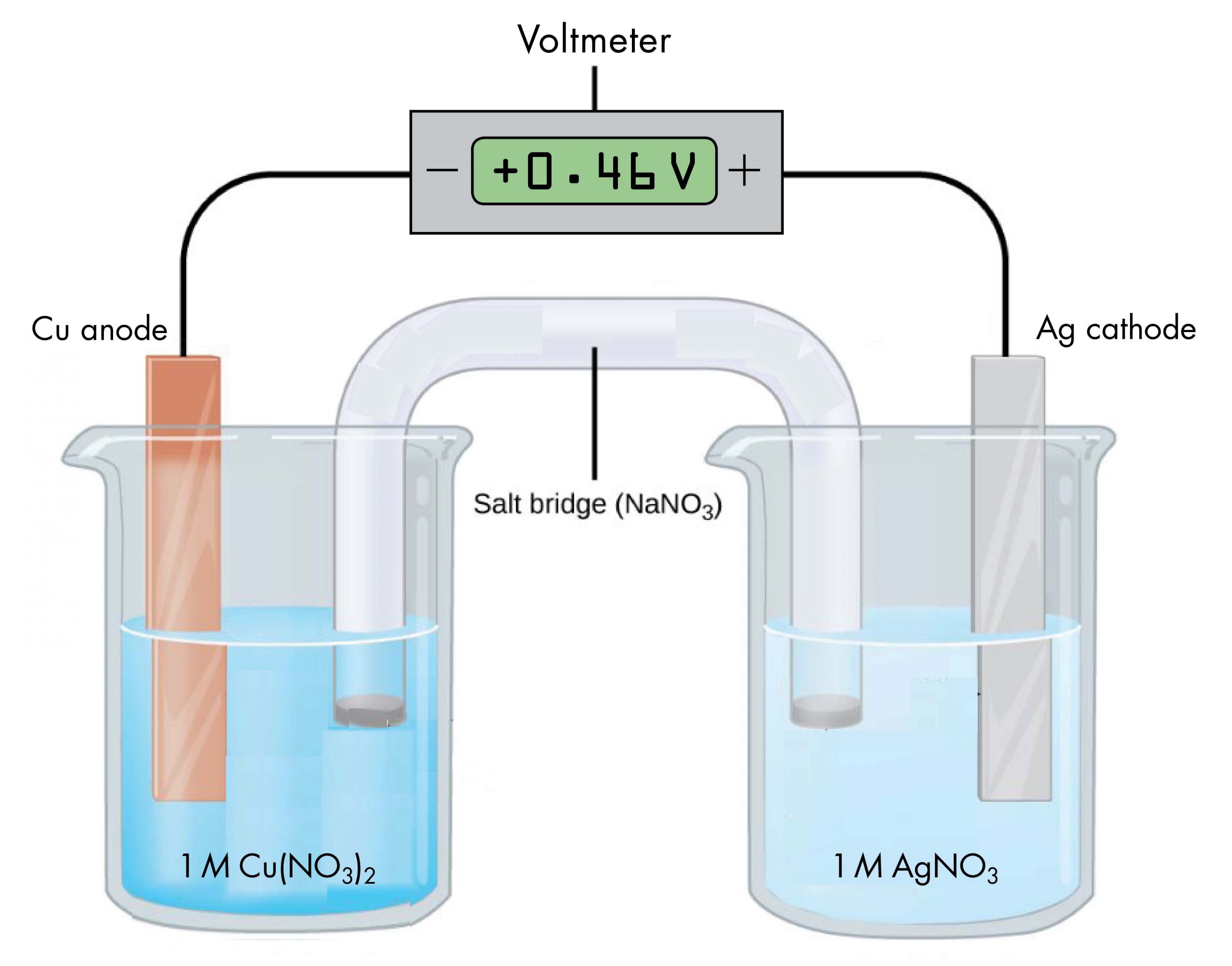
De acuerdo con la ecuación de reacción, el cobre pierde electrones y se oxida a iones cobre (II), por lo que la media celda con el electrodo de cobre en la Figura 1 es el ánodo. De acuerdo con la ecuación de reacción, los iones de plata ganan electrones y se reducen a plata, por lo que la media celda con el electrodo de plata es el cátodo. El electrodo de cobre es más negativo que el electrodo de plata.
Cuando el electrodo de cobre más negativo está conectado al terminal negativo del voltímetro y el electrodo de plata más positivo está conectado al terminal positivo del voltímetro, el medidor lee +0.46 V. Esta lectura se llama el potencial celular, celda E. Es una medida de la energía por unidad de carga disponible de una reacción redox (V = J/C). Un potencial de celda positivo indica cuánto trabajo eléctrico puede hacer una reacción espontánea en una celda voltaica por unidad de carga eléctrica que se mueve a través del circuito.
En condiciones de estado estándar (1 bar o 1 M, como las concentraciones de 1-M en la Figura 1), el potencial celular es el potencial celular estándar, (pronunciado “célula estándar E”). Así, con base en la lectura del voltímetro,
Un medidor como el de la Figura 1 mide la diferencia de potencial eléctrico entre su terminal positivo y su terminal negativo. Debido a que el terminal positivo del medidor está a la derecha, el potencial de la celda es la diferencia en el potencial eléctrico entre la media celda derecha y la media celda izquierda, y podemos escribir,
\[E_{\text{cell}} = E_{\text{right half-cell}} - E_{\text{left half-cell}} \nonumber \]
En la Figura 1, todas las concentraciones son de 1 M (condiciones de estado estándar), por lo que también podemos escribir,
\[E^{\circ}_{\text{cell}} = E^{\circ}_{\text{right half-cell}} - E^{\circ}_{\text{left half-cell}} \nonumber \]
Si las conexiones de cable se invierten, un voltímetro típico leería −0.46 V. Esto proporciona una manera experimental de determinar qué media celda es el cátodo y cuál es el ánodo: una lectura positiva del voltímetro indica que el terminal negativo del medidor está conectado al ánodo y el terminal positivo está conectado al cátodo; una lectura de voltímetro negativo indica que el terminal negativo está conectado al cátodo y el terminal positivo está conectado al ánodo.
El potencial celular de una celda voltaica depende de las sustancias en cada media celda y de las concentraciones de soluciones y presiones parciales de los gases involucrados en la semicelda. El potencial de media celda no depende de si se está produciendo una semirreacción o de la dirección en la que va la semirreacción. Es decir, el potencial de la media célula que involucra iones de plata y plata es el mismo si la plata se oxida a iones de plata o los iones de plata se reducen a plata.
Un puente de sal debe estar presente para completar un circuito eléctrico. En el puente de sal cuando la célula genera corriente eléctrica, un ion se mueve hacia la oda y los iones de gato se mueven hacia la hode gato.
Notación de celdas D39.2
Dibujar un diagrama, como en la Figura 1 anterior, para definir una celda voltaica lleva mucho tiempo. La notación celular es una abreviatura que resume la información importante sobre una celda voltaica. En notación celular, una línea vertical, |, denota un límite de fase y una línea doble, ||, un puente de sal. El electrodo de ánodo se escribe a la izquierda, seguido de la solución de ánodo, luego el puente de sal, luego la solución catódica y, finalmente, el electrodo catódico a la derecha. La Figura 2 muestra cómo la notación de celda para una celda voltaica se relaciona con varios componentes de la celda.

Obsérvese que los iones de espectador, como NO 3 −, no están incluidos en la notación celular, y si hay coeficientes en una media reacción los coeficientes no se incluyen (es decir, los coeficientes de 2 en la media reacción de plata no aparecen en la notación celular). Cuando se conocen, las concentraciones iniciales de iones generalmente se incluyen en la notación celular, por lo que una notación celular más completa para la célula en la Figura 2 es Cu (s) | Cu 2+ (aq, 1 M) || Ag + (aq, 1 M) | Ag (s).
Algunas reacciones redox involucran especies que son conductores pobres de la electricidad, como gases o sólidos iónicos. Para tales sustancias, se utiliza un electrodo inerte, que no participa en las reacciones. Un ejemplo de tal célula voltaica se muestra en la Figura 3.
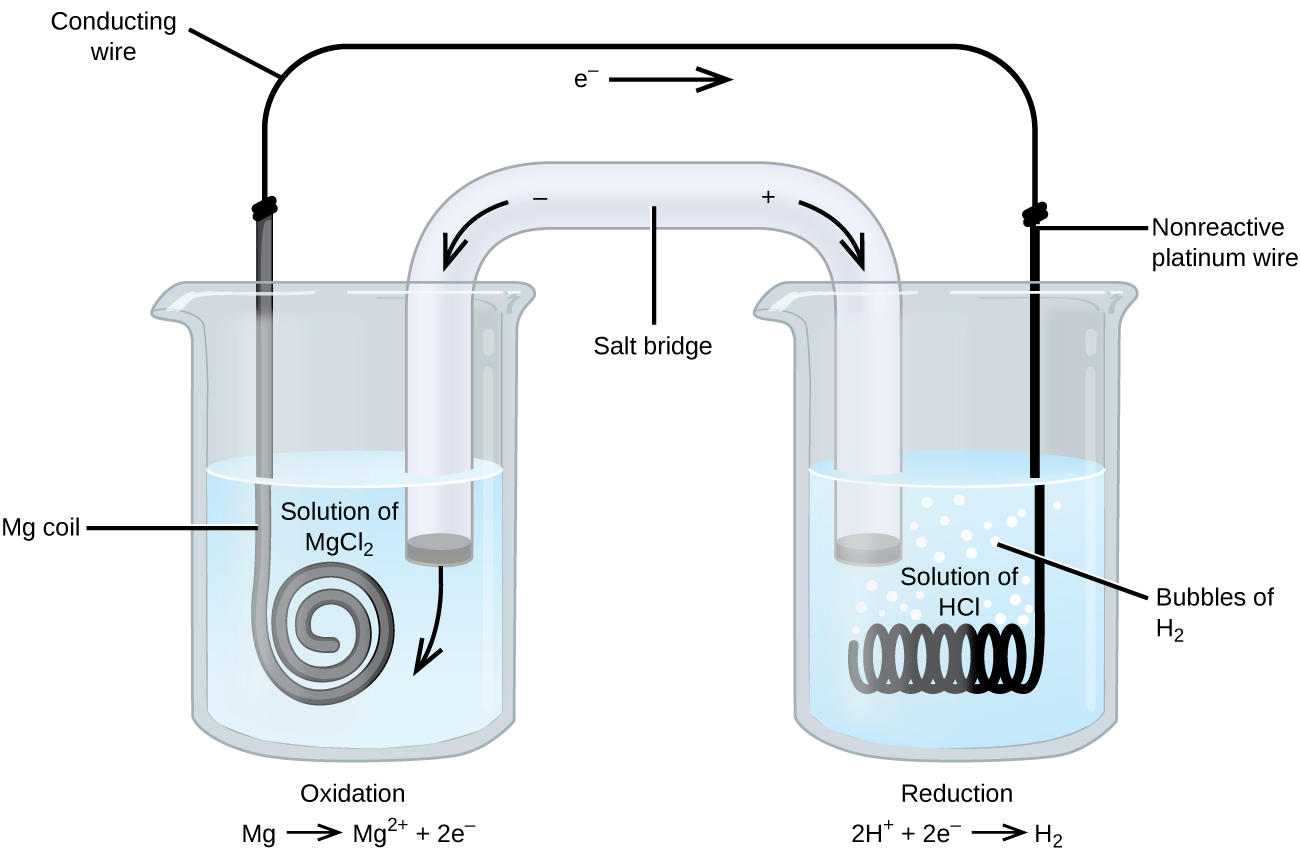
La reacción redox involucrada es:
| Oxidación (ánodo): | Mg (s) | ⟶ | Mg 2 + (aq) + 2e − |
| Reducción (cátodo): | 2H + (aq) + 2e − | ⟶ | H 2 (g) |
| en general: | Mg (s) + 2H + (aq) | ⟶ | Mg 2 + (aq) + H 2 (g) |
Esta celda voltaica utiliza un alambre inerte de platino para el cátodo, por lo que la notación de celda es:
Mg (s) | Mg 2+ (aq) || H + (aq) | H 2 (g) | Pt (s)
El electrodo de magnesio es un electrodo activo porque participa en la reacción redox. Los electrodos inertes, como el electrodo de platino en la Figura 3, no participan en la reacción redox sino que deben estar presentes para que haya un circuito eléctrico completo. El platino y el oro se encuentran entre los metales menos reactivos, por lo que son buenas opciones para electrodos inertes. El grafito, también inerte a muchas reacciones químicas, es otra opción común.
Potenciales de media celda estándar D39.3
El potencial celular en la Figura 1 (+0.46 V) resulta de la diferencia en el potencial eléctrico entre las medias celdas. No es posible medir directamente el potencial de una sola media celda; una media celda tiene que estar conectada a otra media celda para medir una tensión.
Sin embargo, es útil tabular potenciales para semiceldas individuales, de tal manera que el potencial para una celda voltaica construida a partir de dos medias celdas cualesquiera se pueda calcular a partir de los valores de la tabla. Para crear una tabla de este tipo, todos los potenciales de media celda deben medirse en relación con la misma semicelda de referencia. Esa media celda es el electrodo de hidrógeno estándar (SHE) (Figura 4), que consiste en gas hidrógeno a una presión de 1 bar burbujeando a través de una solución 1 M H + (ac) (se usa platino como electrodo inerte):
2 H + (aq, 1 M) + 2 eH 2 (g, 1 bar) E° = 0 V
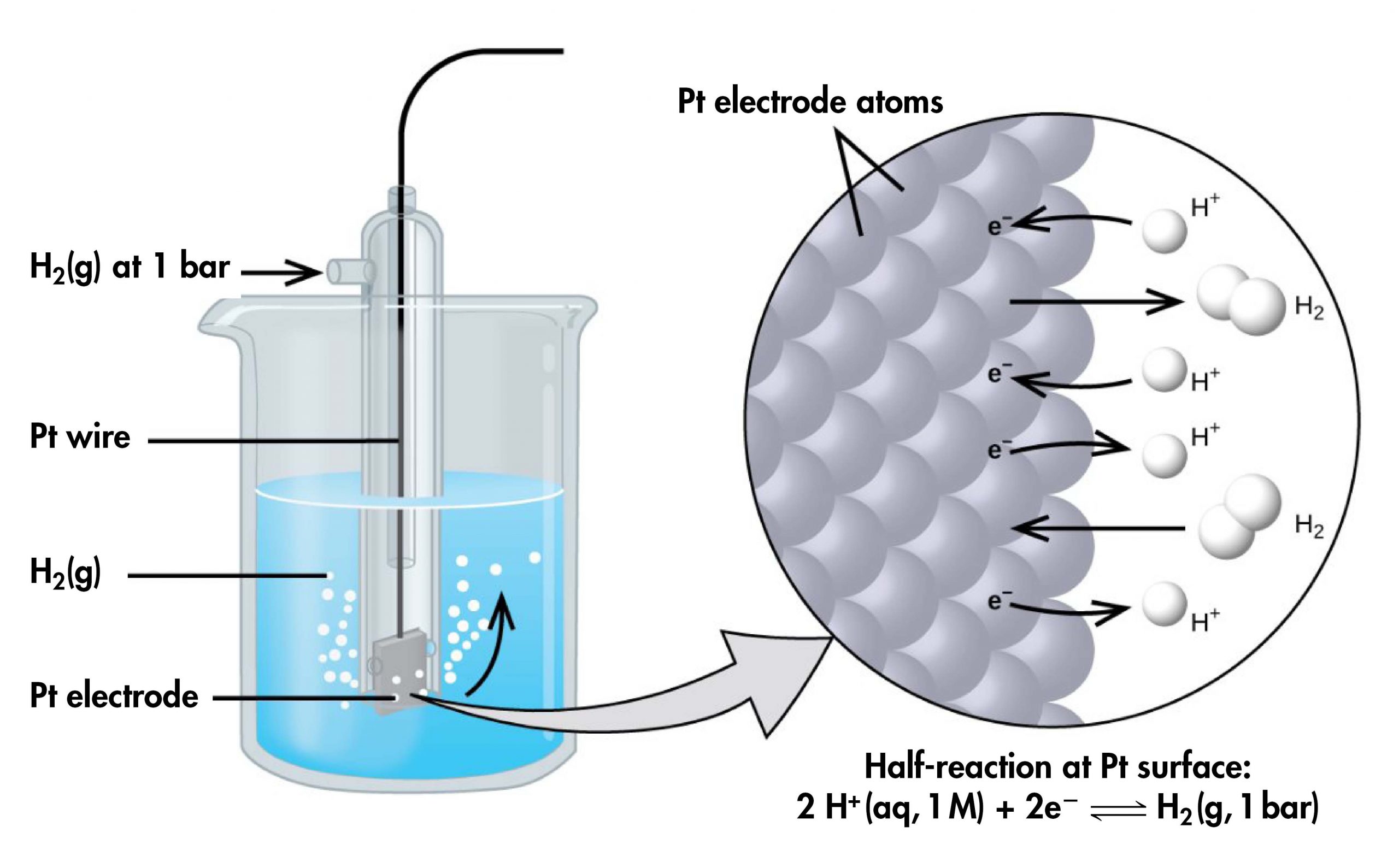
Si se configura una celda con la SHE a la izquierda y la media celda cuyo potencial queremos medir a la derecha, con todas las concentraciones 1 M y todas las presiones parciales de gas 1 bar, entonces la lectura en el voltímetro es E°, el potencial de media celda estándar, para la media celda encendida la derecha. (A menos que se especifique, la temperatura normalmente se supone que es de 25 ºC). Para mediciones de alta precisión el voltímetro no debe permitir que fluya ninguna corriente; es decir, no se produce ninguna reacción química.
Por ejemplo, una célula voltaica consistió en una SHE y una media celda Cu 2+ | Cu (s) (Figura 5) se puede utilizar para determinar el potencial estándar de media celda para Cu 2+ | Cu (s).
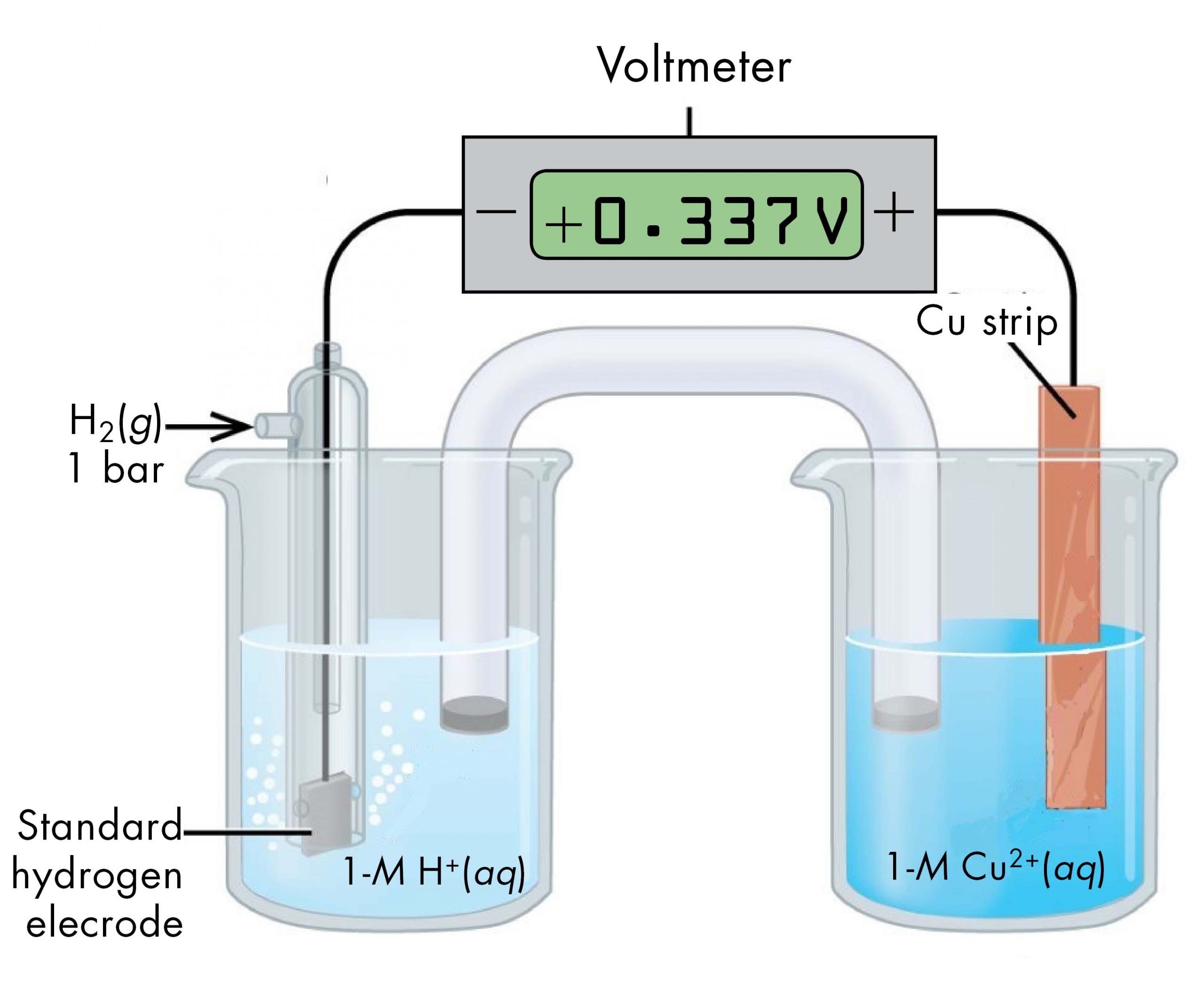
La notación de celda para esta celda voltaica es:
Pt (s) | H 2 (g, 1 bar) | H + (aq, 1 M) || Cu 2+ (aq, 1 M) | Cu (s)
Como señalamos en la Sección D39.1, el potencial de celda, celda E°, medido por el voltímetro, es la diferencia entre el potencial de la media celda derecha y la media celda izquierda:
E° celda = E° media celda derecha — E° media celda izquierda
A partir de la celda E° medida = +0.337 V y el potencial definido de cero para la media celda Pt (s) | H 2 (g, 1 bar) | H + (aq, 1 M), podemos calcular E° de la media celda Cu 2+ (aq, 1 M) | Cu (s):
+0.337 V = E° Cu 2+ |Cu — E° H + |H 2 = E° Cu 2+ |Cu — 0 = E° Cu 2+ |Cu
En ocasiones, cuando se configura una celda con la SHE a la izquierda, la lectura en el voltímetro es negativa. Es decir, para algunas medias células el potencial estándar de media celda es menor que el potencial para la semicelda Pt (s) | H 2 (g, 1 bar) | H + (aq, 1 M). Considere la celda que se muestra en la Figura 6, con notación de celda
Pt (s) | H 2 (g, 1 bar) | H + (aq, 1 M) || Zn 2 + (aq, 1 M) | Zn (s)
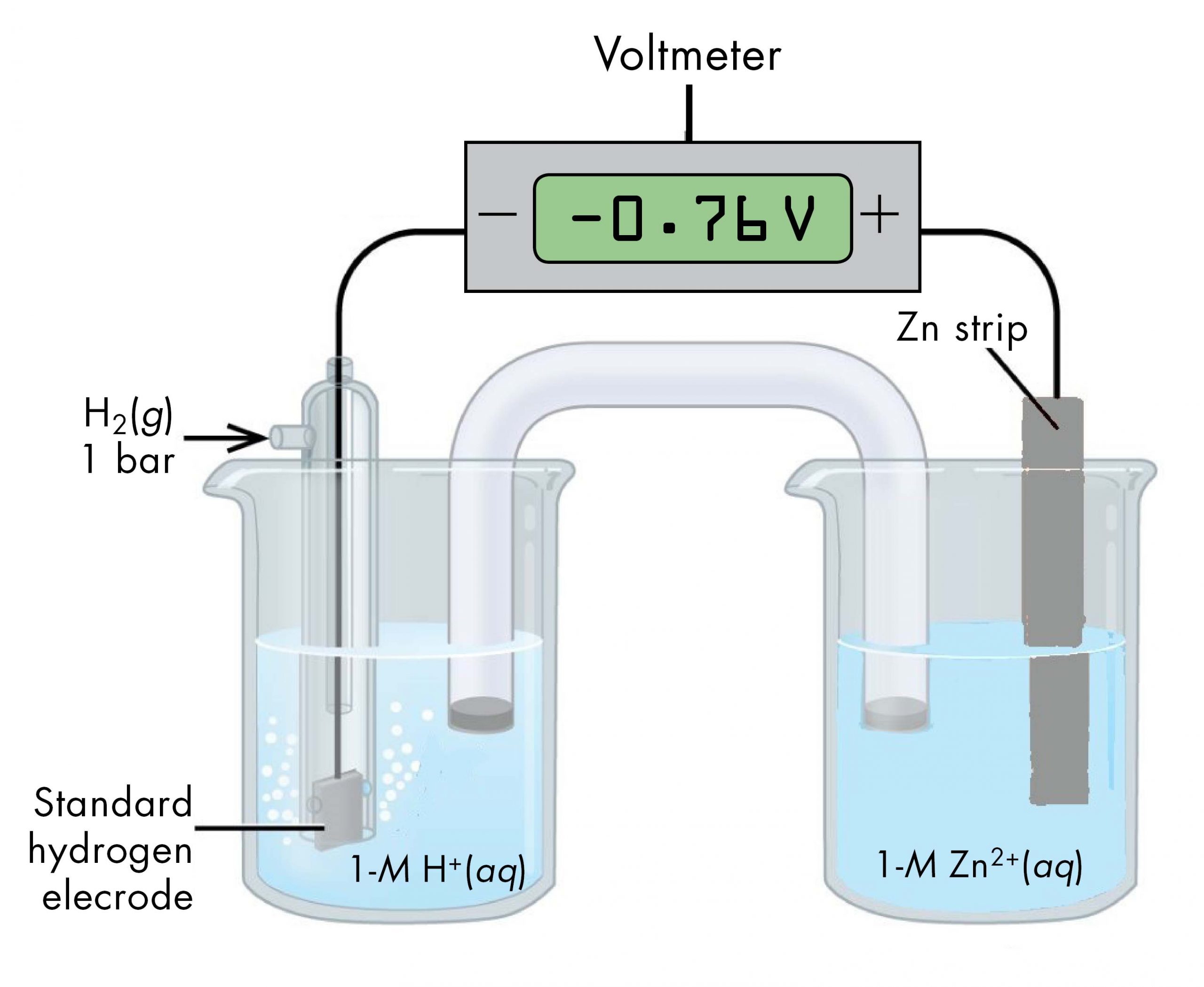
Siguiendo el mismo razonamiento que para el Cu 2+ (aq, 1 M) | Cu (s) semicelda, se puede calcular E° de la media celda Zn 2 + (aq, 1 M) | Zn (s).
E° celda = E° media celda derecha — E° media celda izquierda
\[-0.76\;\text{V} = E_{\text{Zn}^{2+}|\text{Zn}}^{\circ}\;-\;E_{\text{H}^{+}|\text{H}_2}^{\circ} = E_{\text{Zn}^{2+}|\text{Zn}}^{\circ}\;-\;0 = E_{\text{Zn}^{2+}|\text{Zn}}^{\circ} \nonumber \]
Puede parecer extraño que el potencial estándar de media celda sea negativo. Esto solo refleja el hecho de que el potencial eléctrico de la semicelda Zn 2 + (aq, 1 M) | Zn (s) es menor que el potencial eléctrico de la semicelda Pt (s) | H 2 (g, 1 bar) | H + (aq, 1 M). El potencial de una semicelda depende únicamente de la composición de la semicelda y no depende de la dirección de una semirreacción ni de una reacción global.
El electrodo de hidrógeno estándar es bastante peligroso porque H 2 (g) es muy inflamable. De ahí que rara vez se utilice en el laboratorio. Su principal significación es que establece el “cero” para los potenciales estándar de media celda. La mayoría de los potenciales de media celda estándar se miden configurando una celda voltaica con una media celda de potencial estándar conocido y una media celda de potencial estándar desconocido (por medir).
D39.4 Uso de potenciales de media celda estándar
Con base en los métodos descritos en la sección anterior, se han determinado potenciales de media celda estándar para muchas medias células. La siguiente tabla da los potenciales de semicelda para semiceldas seleccionadas. Haga clic en la mesa para abrir una versión que pueda ampliarse o imprimirse.

Hay varios aspectos importantes a tener en cuenta:
- El agente oxidante está en el lado izquierdo (reactante) de una ecuación de media reacción de reducción.
- Los agentes oxidantes más fuertes (las sustancias más fáciles de reducir) tienen los mayores valores positivos de E° y están en la parte superior de la tabla. (Por ejemplo, F 2 (g) es un agente oxidante muy fuerte).
- El agente reductor está en el lado derecho (producto) de una ecuación de media reacción de reducción.
- Los agentes reductores más fuertes (las sustancias que se oxidan más fácilmente) tienen los valores E° más negativos y se encuentran en la parte inferior de la tabla. (Por ejemplo, Li (s) y K (s) son agentes reductores muy fuertes).
- Una reacción redox es favorecida por el producto cuando un agente oxidante más fuerte reacciona con un agente reductor más fuerte. Esto da como resultado un valor positivo para la celda E° cuando la semi-reacción de oxidación se combina con la semirreacción de reducción.
- Las reacciones de media célula son reversibles y la dirección en la que va una reacción de media célula depende del potencial de la otra semicelda a la que está conectada en una célula.
La tabla de potenciales de media celda estándar se puede utilizar para determinar la celda E° para cualquier célula voltaica y predecir si una reacción redox específica es favorecida por el producto. Por ejemplo, para la celda:
Cu (s) | Cu 2+ (aq, 1 M) || Ag + (aq, 1 M) | Ag (s)
E° celda = E° media celda derecha — E° media celda izquierda = E° Ag + |Ag — E° Cu 2+ |Cu = 0.7991 V — 0.340 V = 0.459 V
Debido a que el valor de la celda E° es positivo, la reacción redox correspondiente a esta notación celular es favorecida por el producto y la celda voltaica puede producir energía eléctrica. La reacción global se puede obtener a partir de la notación celular escribiendo las semi-reacciones de oxidación y reducción, multiplicando cada semirreacción por un número apropiado para equilibrar los electrones, y sumando las dos medias reacciones:
| Oxidación (izquierda): | Cu (s) | ⟶ | Cu 2 + (aq) + 2e − | Ánodo E° = +0.340 V |
| Reducción (derecha): | 2 × (Ag + (aq) + e − | ⟶ | Ag (s)) | E° cátodo = +0.7991 V |
| En general: | Cu (s) + 2Ag + (aq) | ⟶ | Cu 2 + (aq) + 2Ag (s) | Celda E° = +0.459 V |
Tenga en cuenta que:
- A pesar de que la media reacción de reducción se multiplica por 2, el cátodo de E° no se multiplica por 2 cuando se calcula la celda de E°. Esto se debe a que el potencial eléctrico es una relación de energía por culombo de carga transferida (V = J/C). Si se duplica la media reacción, tanto la energía como la carga transferida se duplican, dejando la relación constante.
- La semirreacción de oxidación es la inversa de la reacción como se muestra en la tabla de potencial de media celda, pero E° derecha no se multiplica por -1. El potencial celular no depende de la dirección de una media reacción; depende únicamente de la composición de la semicelda.
E° para muchas medias celdas se incluyen en el apéndice. Tablas como estas permiten determinar la celda E° para muchas reacciones redox. Además, comparando los potenciales estándar, podemos discernir qué especie es más fácil de reducir/más difícil de oxidar/es un agente oxidante más fuerte (mayor /más positivo E°) y qué especie es más fácil de oxidar/más difícil de reducir/es un agente reductor más fuerte (menor /más negativo E°).
Pregunta Podia
Utilice los datos de la tabla de potenciales semicelulares estándar para determinar si esta reacción redox está favorecida por el producto.
2 NO 3 − (aq) + 8 H + (aq) + 3 Cd (s) 2 NO (g) + 3 Cd 2 + (aq) + 4 H 2 O (l)
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


