5.5: Día 40- Propiedades Termodinámicas de Celdas Voltáicas y Electrolíticas
- Page ID
- 78899
36
Día 40: Propiedades Termodinámicas de Celdas Voltáicas y Electrolíticas
D40.1 Relaciones entre las celdas Δ r G°, K° y E°
Una reacción redox se puede describir en términos de Δ rG° y K°, y estas variables termodinámicas pueden estar relacionadas con la celda E° porque todas describen si la reacción redox es favorecida por el reactivo o favorecida por el producto en equilibrio.
En una celda voltaica, la diferencia de energía libre de Gibbs entre productos y reactivos permite que la celda realice trabajos eléctricos. Representamos el trabajo eléctrico realizado por la celda como w elec.
w elec (J) = carga transferida (C) × diferencia de potencial (V)
La carga de 1 mol de electrones se conoce como la constante de Faraday (F):
\[F = \dfrac{6.0221\;\times\;10^{23}\;\text{e}^{-}}{\text{mol}}\;\times\;\dfrac{1.6022\;\times\;10^{-19}\;\text{C}}{\text{e}^{-}} = 96485\;\frac{\text{C}}{\text{mol}} = 96485\frac{\text{J}}{\text{V}{\cdot}\text{mol}} \nonumber \]
Por lo tanto, la cantidad total de carga transferida por mol de una reacción redox es:
\[\dfrac{\text{total charge transferred}}{\text{mole of reaction}} = (\text{number of e}^-\;\text{transferred}) \;\times\; F = n\;\times\;F \nonumber \]
En esta ecuación, n es el número de electrones transferidos en la reacción redox equilibrada, que se puede obtener de las medias reacciones equilibradas que se agregan para producir la reacción redox global. Por ejemplo, en la reacción:
2 Au 3 + (aq) + 3 Zn (s) → 3 Zn 2 + (aq) + 2 Au (s)
6 e − se transfieren porque cada media reacción, después de multiplicar por un factor para equilibrar electrones, implica 6 e −:
| Oxidación: | 3 × (Zn (s) | ⟶ | Zn 2 + (aq) + 2e −) |
| Reducción: | 2 × (Au 3 + (aq) + 3e − | ⟶ | Au (s)) |
| En general: | 2 Au 3 + (aq) + 3 Zn (s) | ⟶ | 3 Zn 2 + (aq) + 2 Au (s) |
Cuando esta reacción redox ocurre una vez, se transfieren 6 e −. Cuando tiene lugar un mol de esta reacción, se transfieren 6 moles de e −; es decir, se transfieren 6 mol × 96485 C/mol = 578910 C. Por lo tanto, tenemos:
| w elec | = | carga transferida × diferencia de potencial |
| w elec | = | (nF) × (celda E) |
Si operamos una celda voltaica de tal manera que se haga el máximo trabajo eléctrico posible, w elec, y el único trabajo realizado sea el trabajo eléctrico, entonces:
Δ r G = − w max = − w elec = −nFe celda
El signo negativo tiene sentido porque una célula E positiva indica una reacción redox espontánea mientras que para Δ r G, un valor negativo indica una reacción espontánea.
Si todos los reactivos y productos están en sus estados estándar, entonces la ecuación se convierte en:
Δ r G ° = — NFe° celda
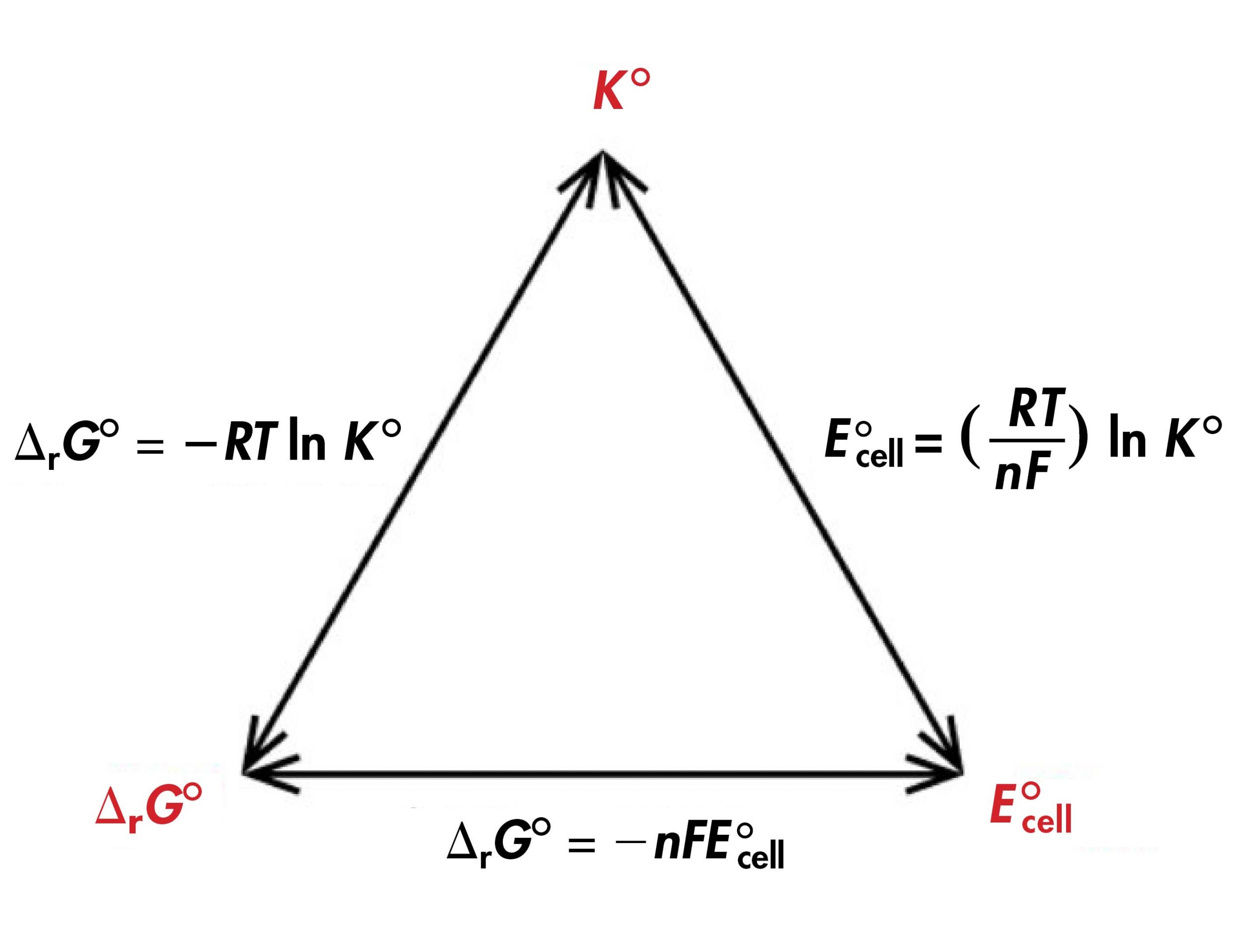
Esta ecuación también vincula los potenciales celulares estándar con las constantes de equilibrio, ya que:
— NFe° celda = Δ r G° = — RT ln K°
Por lo tanto:
\[E_{\text{cell}}^{\circ} = \dfrac{RT}{nF}\;\text{ln}\;K^{\circ} \nonumber \]
Así, si se conoce o se puede calcular una célula de Δ rG °, K° o E° para una reacción redox, las otras dos cantidades se pueden determinar utilizando las relaciones que se muestran en la Figura 1. Además, cualquiera de las tres cantidades se puede usar para determinar si una reacción es favorecida por el producto en equilibrio.
Ecuación de Nernst D40.2
Ahora que se ha hecho la conexión entre el cambio de energía libre de Gibbs estándar y los potenciales celulares estándar, podemos considerar la situación bajo condiciones no estándar. Recordemos que Δ r G está relacionado con Δ rG° por el cociente de reacción, Q, y una relación similar se puede aplicar a los potenciales celulares:
| Δ r G | = | Δ r G° + RT ln Q |
| — Célula NFe | = | — NFe° celda + RT ln Q |
Reorganizar las variables da la ecuación de Nernst:
\[E_{\text{cell}} = E_{\text{cell}}^{\circ}\;-\;\dfrac{RT}{nF}\;\text{ln}\;Q \nonumber \]
La ecuación de Nernst se puede utilizar para calcular el potencial celular a concentraciones o presiones parciales que difieren de las condiciones estándar, lo que suele ser el caso de las células voltáicas.
Actividad 1: ¿Es espontánea una reacción redox?
Células de concentración D40.3
Una celda de concentración es un tipo especial de celda voltaica donde los electrodos son del mismo material pero las medias celdas tienen diferentes concentraciones de especies solubles. Debido a que una o ambas medias células no están en condiciones de estado estándar, los potenciales de media celda son desiguales y hay una diferencia de potencial entre las medias celdas. Esa diferencia de potencial se puede calcular usando la ecuación de Nernst.
Por ejemplo, considere esta celda de concentración a 25°C:
Zn (s) | Zn 2+ (aq, 0.10 M) || Zn 2+ (aq, 0.50 M) | Zn (s)
El potencial de celda estándar es de 0 V porque el ánodo y el cátodo implican la misma reacción; sin embargo, el proceso es espontáneo porque si se mezclaran volúmenes iguales de las dos soluciones de media celda, la concentración de Zn 2 + cambiaría al promedio de las concentraciones iniciales, es decir, a 0.30 M. La célula puede hacer trabajo porque las concentraciones de Zn 2 + cambian.
| Oxidación: | Zn (s) | ⟶ | Zn 2 + (aq, 0.10 M) + 2e | E° media celda izquierda = -0.763 V |
| Reducción: | Zn 2 + (aq, 0.50 M) + 2e | ⟶ | Zn (s) | E° media celda derecha = -0.763 V |
| En general: | Zn 2 + (aq, 0.50 M) | ⟶ | Zn 2 + (aq, 0.10 M) | Celda E° = 0 V |
La ecuación de Nernst verifica que el proceso es espontáneo en las condiciones dadas, porque muestra que la celda E > 0 V:
\[E_{\text{cell}} = 0\;\text{V}\;-\;\dfrac{\left(8.314\frac{\text{J}}{\text{K}{\cdot}\text{mol}}\right)(298.15\;\text{K})}{(2)\left(96485\frac{\text{J}}{\text{V}{\cdot}\text{mol}}\right)}\;\text{ln}\left(\dfrac{0.10\;\text{M}}{0.50\;\text{M}}\right) = +0.021\;\text{V} \nonumber \]
En una celda de concentración, el potencial celular estándar (celda E°) es siempre cero. Para tener una reacción directa espontánea, y por ende tener un potencial celular positivo (célula E), el cociente de reacción Q debe ser menor a 1 (cuando Q < 1, ln (Q) < 0). A medida que avanza la reacción, las concentraciones cambian, Q se acerca a 1 y la célula E se acerca a 0 V.
Pregunta Podia
La celda de gravedad, una variante de la celda Daniell, fue descrita en el Ejercicio 3 en el Día 39. La célula implica la oxidación de Zn (s) por Cu 2 + (aq). Supongamos que se construye una celda de gravedad con 1.00 L de sulfato de cobre saturado (II) en la parte inferior y 1.00 L de sulfato de zinc 0.100-M en la parte superior. (No hay sulfato sólido de cobre (II) en la celda. Asumir una temperatura de 25 °C.)
Escriba medias reacciones para la reacción general que alimenta la celda de gravedad y etiquetarlas como oxidación y reducción.
Escribe la reacción celular global equilibrada.
Calcular el potencial celular estándar.
Calcular el potencial celular bajo las condiciones iniciales (no estándar). La solubilidad de CuSO 4 •5H 2 O en agua es de 32 g/100 mL.
Calcular el potencial celular después de que 99% de los iones cobre (II) en la solución de la celda inferior haya reaccionado. (Supongamos que hay un exceso de Zn (s).)
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


