5.6: Día 41- Electrólisis; Baterías Comerciales
- Page ID
- 78900
37
Día 41: Electrólisis; Baterías Comerciales
Electrólisis D41.1
En una celda electrolítica, la energía eléctrica suministrada provoca que se produzca una reacción redox no espontánea en un proceso conocido como electrólisis. Una celda electrolítica es lo opuesto a una celda voltaica, donde una reacción redox espontánea produce energía eléctrica.
Por ejemplo, considere la electrólisis del cloruro de sodio fundido. En la Figura 1 se muestra un diagrama simplificado de la celda electrolítica utilizada para la fabricación comercial de metal sodio y gas cloro. En la sal fundida, los iones de sodio se mueven hacia el cátodo y los iones cloruro se mueven hacia el ánodo (tenga en cuenta que los iones negativos se mueven a través del circuito en la misma dirección general que los electrones). Una pantalla porosa permite el movimiento de iones pero no la mezcla del producto sodio metal y gas cloro, que reaccionaría espontáneamente al contacto.
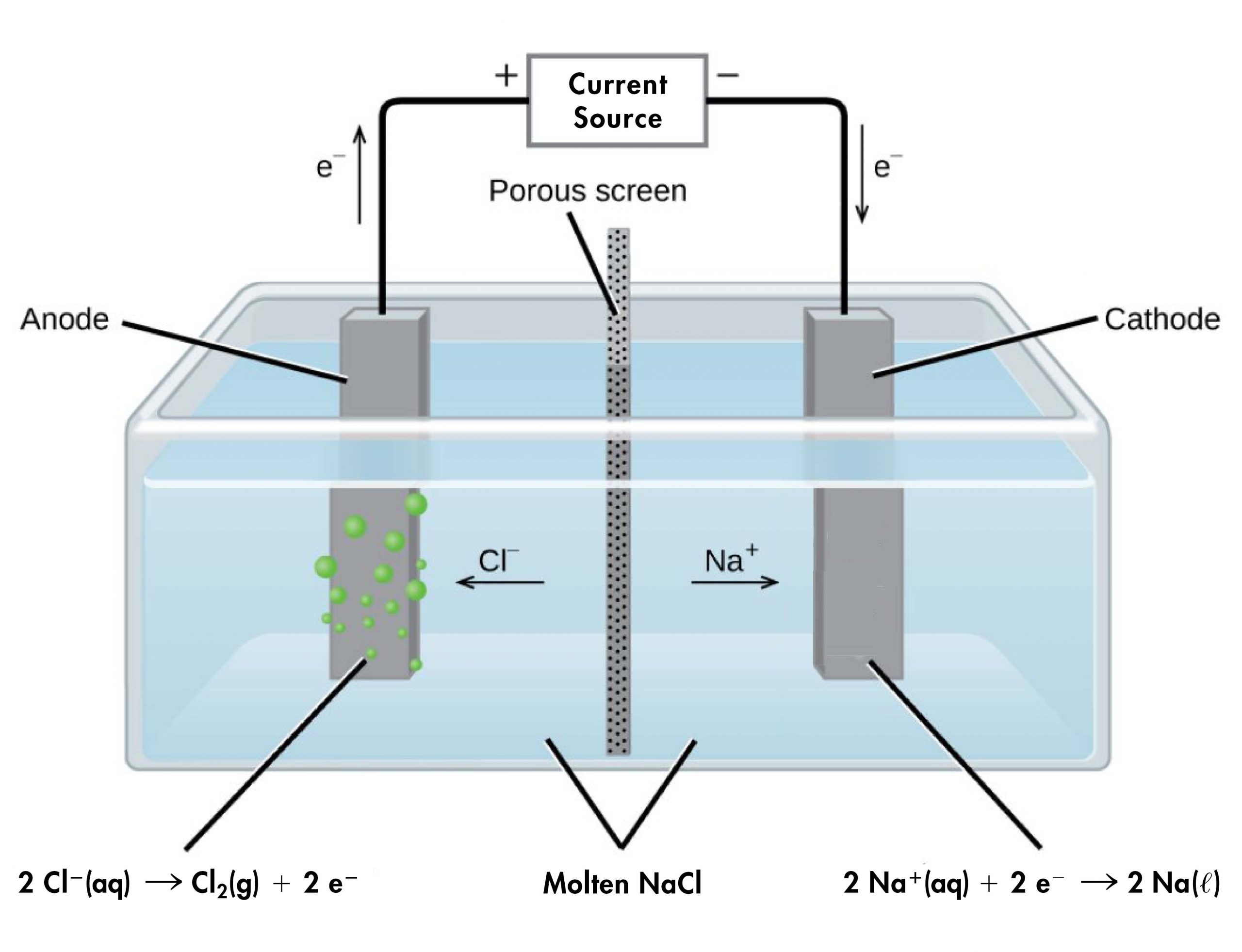
Una fuente externa de corriente eléctrica fuerza electrones en el electrodo en el compartimiento del cátodo, obligando a que ocurra la media reacción de reducción:
Reducción (cátodo): 2 × (Na + (aq) + e⟶ Na (s)) E° Na + |Na = -2.714 V
(A la temperatura del NaCl fundido, el sodio es un líquido, por lo que E° Na + |Na (s) = -2.714 V es una aproximación. E° Na + |Na (l) para sodio líquido no está disponible en el apéndice.)
En el compartimiento del ánodo, se produce la semirreacción de oxidación:
Oxidación (ánodo): 2 Cl( aq) ⟶ Cl 2 (g) + 2eE° Cl 2 |Cl= +1.358 V
Los electrones formados aquí son conducidos a través de un cable al lado positivo de la fuente de voltaje, completando el circuito eléctrico.
Podemos calcular la celda E° para esta celda de electrólisis utilizando el mismo método que usamos para las celdas voltaicas; es decir,
E° celda = E° media celda derecha − E° media celda izquierda = E° cátodo − E° ánodo = -2.714 V − (+1.358 V) = -4.072 V
La reacción general es:
En general: 2 Na + (aq) + 2 Cl( aq) ⟶ 2 Na (s) + Cl 2 (g) E° celda = -4.072 V
La celda E° negativa indica que esta reacción está fuertemente favorecida por los reactivos, y bajo condiciones de estado estándar, la fuente de alimentación debe proporcionar al menos 4.1 V para hacer que se produzca la reacción de electrólisis. En la práctica, los voltajes aplicados son mayores debido a ineficiencias en el propio proceso y también para ayudar a aumentar la velocidad de reacción.
Con la transición de los combustibles fósiles a los suministros de energía renovable, una aplicación importante de la electrólisis es la “división” del agua en gas hidrógeno y gas oxígeno (Figura 2). La energía eléctrica de paneles solares o turbinas eólicas se puede utilizar para sintetizar hidrógeno para su uso como combustible. Para que la corriente pase a través de la solución de manera eficiente, debe haber iones presentes. Por lo tanto, normalmente se añade ácido a la solución de reacción para aumentar la concentración de iones en solución.
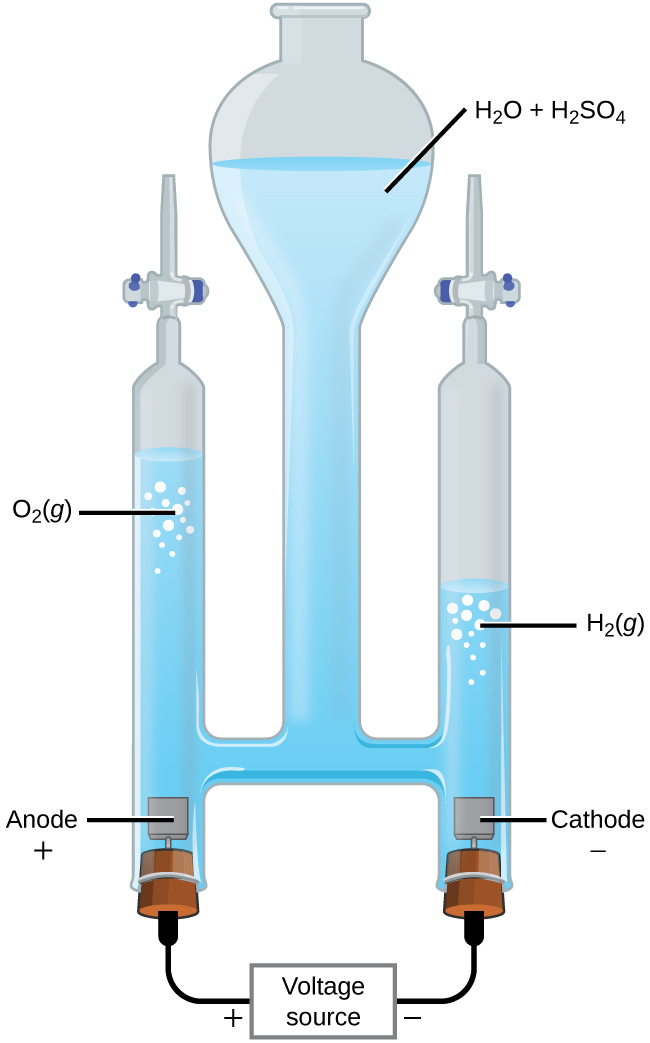
En solución ácida 1-M:
| Oxidación (ánodo): | 2H 2 O (l) | ⟶ | O 2 (g) + 4H + (aq) + 4e | Ánodo E° = +1.229 V |
| Reducción (cátodo): | 2 × (2H + (aq) + 2e | ⟶ | H 2 (g)) | E° cátodo = 0 V |
| En general: | 2H 2 O (l) | ⟶ | O 2 (g) + 2H 2 (g) | Celda E° = -1.229 V |
Se requieren al menos 1.229 V para hacer que este proceso favorecido por el reactivo ocurra en solución ácida 1-M.
Finalmente, considere lo que ocurre durante la electrólisis de una solución acuosa de yoduro de potasio 1-M a 25 °C; en la solución están presentes H 2 O (l), K + (aq) e I( aq). Este ejemplo difiere de los ejemplos anteriores porque se puede oxidar más de una especie y se puede reducir más de una especie.
Considerando primero el ánodo, las posibles reacciones de oxidación son
| (i) | 2I( aq) | ⟶ | I 2 (s) + 2e | Ánodo E° = +0.535 V |
| ii) | 2H 2 O (l) | ⟶ | O 2 (g) + 4H + (aq) + 4e | Ánodo E° = +1.229 V |
(La oxidación de K + a K 2+ no se considera porque K + tiene una configuración de electrones de gas noble-gas y una energía de ionización muy alta, lo que hace que sea muy difícil de oxidar. Aunque I 2 se genera en solución acuosa, aproximamos el E° usando el valor para I 2 (s).)
Debido a que E° celda = E° cátodo — E° ánodo, cuanto más positivo sea el potencial de media celda del ánodo, más negativo sería el potencial de celda. Por lo tanto, el yoduro debe oxidarse en el ánodo porque tiene un potencial de media celda menos positivo. Sin embargo, el pH de una solución de KI 1-M es 7, por lo que [H +] está lejos de las condiciones de estado estándar. Suponiendo que O 2 se produce a 1 bar, aplicar la ecuación de Nernst a la media reacción (ii) da:
\[\begin{array}{rcl} E &=& {E^ \circ } - \dfrac{RT}{nF}\ln \left( \dfrac{1}{[\text{O}_2][\text{H}^+]^4}\right)\\[0.5em] &=& 1.229\text{ V} - \dfrac{\left(8.314 \frac{\text{J}}{\text{K}\cdot\text{mol}}\right) (298.15\;\text{K})}{4\left(96485\frac{\text{J}}{\text{V}\cdot\text{mol}}\right)} \ln \left(\dfrac{1}{(1)(1 \times 10^{-7})^4}\right)\\[0.5em] &=& 1.229\;{\text{ V}} - 0.414\;\text{V}\; =\; 0.815\;\text{V} \end{array} \nonumber \]
(Obsérvese que la reacción dada en la tabla estándar de potencial de media celda es la reacción de reducción “O 2 (g) + 4H + (aq) + 4e⟶ 2H 2 O (l) E° = +1.229 V”, de ahí que el cociente de reacción Q se exprese de acuerdo con la reacción dada.)
La ecuación de Nernst muestra que el ánodo E = +0.815 V para la reacción (ii) a pH = 7, el cual es aún mayor que el ánodo E° para la reacción (i). Por lo tanto, la reacción (i) es el proceso que ocurre en el ánodo y I 2 se forma como producto.
Consideremos ahora las posibles reacciones en el cátodo (reducción de I − no se considera porque I − tiene una configuración de electrones de gas noble-gas y no es energéticamente favorable añadir más electrones):
| iii) | 2H 2 O (l) + 2e | ⟶ | H 2 (g) + 2OH( aq) | E° cátodo = -0.8277 V |
| ii) | K + (aq) + e | ⟶ | K (s) | E° cátodo = -2.925 V |
Para la media reacción (iii), nuevamente necesitamos aplicar la ecuación de Nernst para calcular E a pH = 7, asumiendo que H 2 se produce a 1 bar:
\[\begin{array}{rcl} E &=& {E^ \circ } - \dfrac{RT}{nF}\ln \left( \dfrac{[\text{H}_2][\text{OH}^-]^2}{1}\right)\\[0.5em] &=& -0.8277\text{ V} - \dfrac{\left(8.314 \frac{\text{J}}{\text{K}\cdot\text{mol}}\right) (298.15\;\text{K})}{4\left(96485\frac{\text{J}}{\text{V}\cdot\text{mol}}\right)} \ln \left(\dfrac{(1)(1 \times 10^{-7})^4}{1}\right)\\[0.5em] &=& -0.8277\;{\text{ V}} - (-0.4141\;\text{V})\; =\; -0.4136\;\text{V} \end{array} \nonumber \]
De ahí que la reducción del agua, con cátodo E = -0.4136 V a pH = 7, es mucho más probable que ocurra que la reducción de K + (ac) con cátodo E° = -2.925 V. (Esta conclusión está respaldada por el hecho de que el metal de potasio reacciona vigorosamente con el agua para generar K + (aq), gas hidrógeno e iones hidróxido, por lo que si se forman K (s) reaccionaría inmediatamente con agua.)
La reacción general es entonces:
| Oxidación (ánodo): | 2I( aq) | ⟶ | I 2 (s) + 2e | Ánodo E° = +0.535 V |
| Reducción (cátodo): | 2H 2 O (l) + 2e | ⟶ | H 2 (g) + 2OH( aq) | Cátodo E = -0.4136 V |
| En general: | 2H 2 O (l) + 2I( aq) | ⟶ | H 2 (g) + I 2 (s) + 2OH( aq) | Celda E = -0.949 V |
Galvanoplastia
Un uso importante para las celdas electrolíticas es la galvanoplastia, que resulta en una fina capa de metal en la parte superior de una superficie conductora. Los metales típicamente utilizados en galvanoplastia incluyen cadmio, cromo, cobre, oro, níquel, plata y estaño. Como ejemplo de galvanoplastia, considere cómo se produce la vajilla plateada (Figura 3).
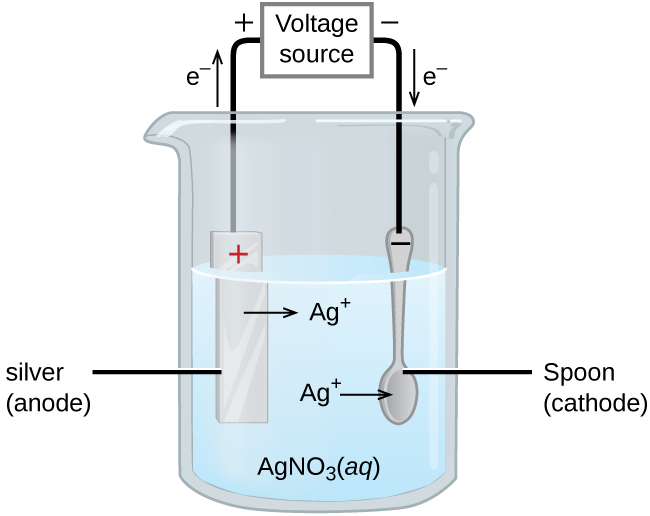
El ánodo consiste en un electrodo de plata. El cátodo es una cuchara hecha de un metal menos costoso. Ambos electrodos se sumergen en una solución de nitrato de plata. A medida que aumenta el potencial de la fuente de voltaje, la corriente fluye. El metal plateado se pierde en el ánodo a medida que entra en solución:
ánodo: Ag (s) ⟶ Ag + (aq) + e −
La masa del cátodo aumenta a medida que los iones de plata de la solución se depositan sobre la cuchara:
cátodo: Ag + (aq) + e − ⟶ Ag (s)
El resultado neto es la transferencia de plata metálica del ánodo al cátodo. La calidad del objeto electrochapado depende del grosor de la plata depositada y de la velocidad de deposición.
Aspectos cuantitativos de la electrólisis
La cantidad de corriente que fluye en una celda electrolítica viene dictada por la cantidad (mol) de electrones transferidos en una reacción redox, la cual a su vez se relaciona con cantidades de reactivos y productos vía estequiometría de reacción. Recordemos que la corriente, I, está relacionada con la carga total, Q:
\[I = \dfrac{Q}{t} \;\;\;\;\; \left(\text{SI units:}\;\ A = \dfrac{C}{s}\right) \nonumber \]
Por lo tanto:
Q = (cantidad e − transferida) × F = I × t
donde F es la constante de Faraday.
Baterías Comerciales D41.2
Muchos de los dispositivos que usamos todos los días, como computadoras portátiles y teléfonos inteligentes, funcionan con baterías. Una batería es una celda electroquímica o serie de celdas que produce una corriente eléctrica. En principio, cualquier célula voltaica puede ser utilizada como batería. Una batería ideal nunca se agotaría, produciría un voltaje constante y sería capaz de soportar temperaturas y humedad extremas ambientales. Las baterías reales logran un equilibrio entre las características ideales y las limitaciones prácticas.
Por ejemplo, la masa de una batería de arranque de automóvil es de aproximadamente 18 kg o ~ 1% de la masa de un automóvil promedio. Este tipo de batería suministraría energía casi ilimitada si se usara en un teléfono inteligente, pero sería completamente poco práctica debido a su masa y tamaño. Por lo tanto, ninguna batería es “la mejor” y se seleccionan diferentes baterías para aplicaciones particulares, teniendo en cuenta cosas como su masa, costo, confiabilidad y capacidad de corriente.
Existen dos tipos básicos de baterías: primaria y secundaria. A continuación se describen algunas baterías de cada tipo.
D41.3 Baterías Primarias
Las baterías primarias son baterías de un solo uso que no se pueden recargar.
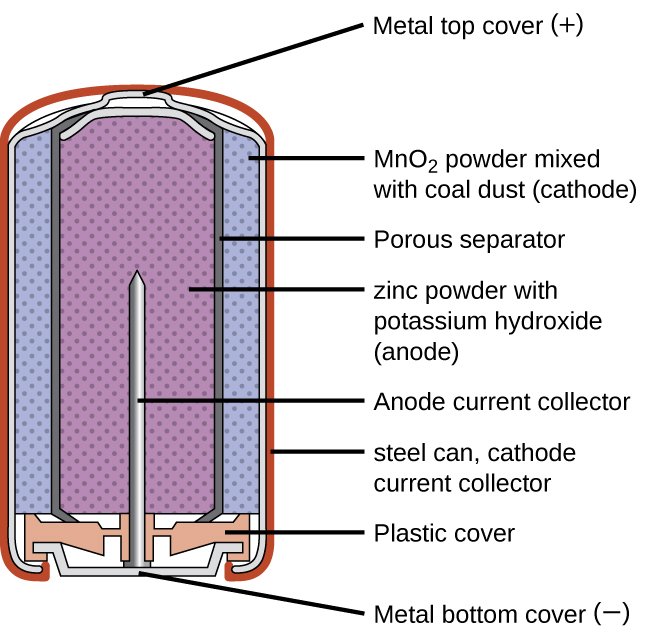
Batería de Zinc-Carbono
Una batería primaria común es la celda seca (Figura 4), que es una batería de zinc-carbono. El zinc sirve tanto como recipiente como electrodo negativo. El electrodo positivo es una varilla hecha de carbono que está rodeada por una pasta de óxido de manganeso (IV), cloruro de zinc, cloruro de amonio, polvo de carbono y una pequeña cantidad de agua.

La reacción en el ánodo se puede representar como la oxidación del zinc:
Zn (s) ⟶ Zn 2 + (aq) + 2 eE° ánodo = -0.763 V
La reacción en el cátodo es más complicada, en parte porque se está produciendo más de una reacción de reducción. La serie de reacciones que se producen en el cátodo es aproximadamente:
2MnO 2 (s) + 2NH 4 Cl (aq) + 2e⟶ Mn 2 O 3 (s) + 2NH 3 (aq) + H 2 O (l) + 2Cl( aq)
La reacción general para la batería de zinc-carbono se puede representar como:
2MnO 2 (s) + 2 NH 4 Cl (aq) + Zn (s) ⟶ Mn 2 O 3 (s) + 2NH 3 (aq) + H 2 O (l) + 2 Cl( aq) + Zn 2 + (aq)
El potencial de la celda es de aproximadamente 1.5 V inicialmente, y disminuye a medida que se usa la batería. A medida que el contenedor de zinc se oxida, su contenido eventualmente se escapa, por lo que este tipo de batería no debe dejarse en ningún dispositivo eléctrico por periodos prolongados.
El voltaje entregado por una batería es el mismo independientemente del tamaño de una batería. Por esta razón, las baterías D, C, A, AA y AAA tienen el mismo voltaje. Sin embargo, las baterías más grandes pueden entregar más moles de electrones y, por lo tanto, durarán más si alimentan el mismo dispositivo.
Pilas alcalinas
Las baterías alcalinas (Figura 5) se desarrollaron en la década de 1950 en parte para abordar algunos de los problemas de rendimiento con las celdas secas de zinc-carbono, y se fabrican para ser sus reemplazos exactos. Como su nombre indica, este tipo de baterías utilizan electrolitos alcalinos, a menudo hidróxido de potasio.
Las reacciones son:
| Oxidación (ánodo): | Zn (s) + 2OH( aq) | ⟶ | ZnO (s) + H 2 O (l) + 2e | Ánodo E° = -1.28 V |
| Reducción (cátodo): | 2MnO 2 (s) + H 2 O (l) + 2e | ⟶ | Mn 2 O 3 (s) + 2OH( aq) | E° cátodo = +0.15 V |
| en general: | Zn (s) + 2MnO 2 (s) | ⟶ | ZnO (s) + Mn 2 O 3 (s) | Celda E° = +1.43 V |
Una batería alcalina puede entregar aproximadamente de tres a cinco veces la energía de una celda seca de zinc-carbono de tamaño similar. Las baterías alcalinas a veces filtran hidróxido de potasio, por lo que estos también deben retirarse de los dispositivos para su almacenamiento a largo Si bien algunas pilas alcalinas son recargables, la mayoría no lo son. Los intentos de recargar una batería alcalina que no es recargable a menudo conducen a la ruptura de la batería y la fuga del electrolito de hidróxido de potasio.
Baterías Secundarias D41.4
Las baterías secundarias son recargables; es decir, la reacción que alimenta la batería se puede revertir para que los reactivos originales puedan regenerarse. Las baterías secundarias se encuentran en teléfonos inteligentes, tabletas electrónicas, automóviles y muchos otros dispositivos.
Batería de plomo-ácido
La batería de plomo-ácido (Figura 6) es el tipo de batería secundaria utilizada para arrancar automóviles alimentados por gasolina. Es económico y capaz de producir la alta corriente que requieren los motores de arranque al arrancar un automóvil. Son pesados debido a la alta densidad del plomo, contienen ácido sulfúrico concentrado altamente corrosivo y deben desecharse adecuadamente para evitar riesgos de envenenamiento por plomo. Pero pueden producir mucha corriente en poco tiempo así que para ciertas aplicaciones son la mejor opción.
Las reacciones para una batería de plomo-ácido son:
| Oxidación (ánodo): | Pb (s) + HSO 4 (aq) | ⟶ | PbSO 4 (s) + H + (aq) + 2e |
| Reducción (cátodo): | PbO 2 (s) + HSO 4 (aq) + 3H + (aq) + 2e | ⟶ | PbSO 4 (s) + 2H 2 O (l) |
| en general: | Pb (s) + PbO 2 (s) + 2H 2 SO 4 (aq) | ⟶ | 2PbSO 4 (s) + 2H 2 O (l) |
Cada celda produce 2.05 V, por lo que se pueden conectar seis celdas en serie para producir una batería de automóvil de 12 V.
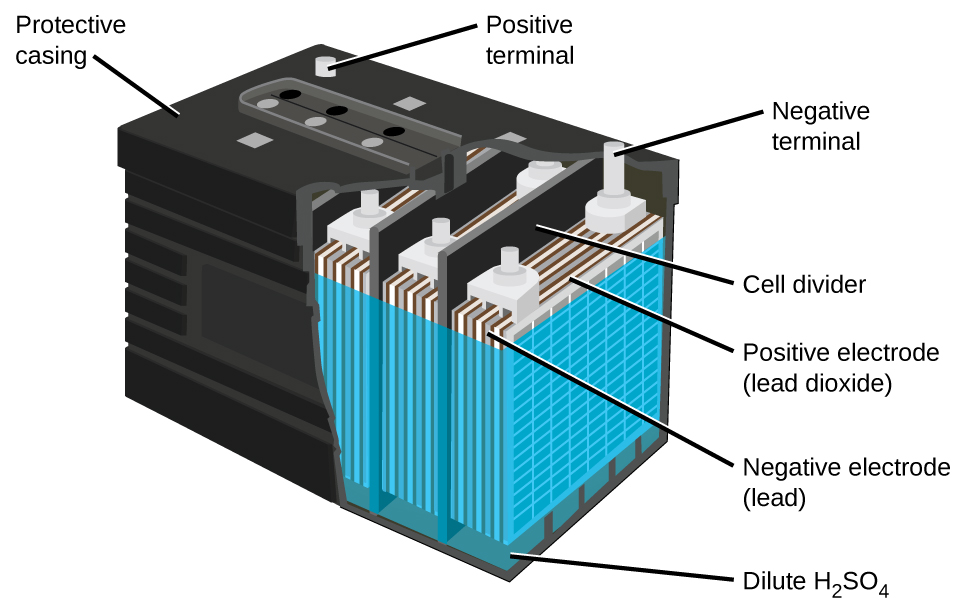
En cada celda, los electrodos de plomo se sumergen en ácido sulfúrico. Los ánodos son esponjosos de plomo metálico y los cátodos son plomo impregnados con óxido de plomo. A medida que se descarga la batería, se forma un polvo de PbSO 4 en los electrodos. Cuando una batería de plomo-ácido es recargada por el alternador de un automóvil, los electrones son forzados a fluir en la dirección opuesta lo que invierte las reacciones en el ánodo y el cátodo, es decir, la celda experimenta reacciones de electrólisis para reponer las sustancias que han reaccionado.
Prácticamente, el ácido sulfúrico concentrado se vuelve bastante viscoso cuando la temperatura es baja, inhibiendo el flujo de iones entre las placas y reduciendo la corriente que se puede suministrar. Este efecto es bien conocido por cualquiera que haya tenido dificultades para arrancar un automóvil en clima frío. Estas baterías también tienden a autodescargarse lentamente, por lo que un automóvil que se quedó inactivo durante varias semanas podría no poder arrancar. Y después de miles de ciclos de descarga-carga, el PbSO 4 que no se convierte a PbO 2 cambia gradualmente a una forma inerte que limita la capacidad de la batería. Además, la carga “rápida” provoca una rápida evolución del gas H 2 potencialmente explosivo del agua en el electrolito (electrólisis del agua); las burbujas de gas se forman en la superficie del plomo y pueden arrancar el PbO 2 de los electrodos. Eventualmente se acumula suficiente material sólido en la parte inferior del electrolito para cortocircuitar la batería, lo que lleva a su desaparición permanente.
Batería de iones de litio
Las baterías de iones de litio (Figura 7) se encuentran entre las baterías recargables más populares y se utilizan en muchos dispositivos electrónicos portátiles debido a que sus ventajas superan la desventaja de un mayor costo. En una batería típica de Li-ion las reacciones son:
| Oxidación (ánodo): | LiCoO 2 | ⟶ | Li 1 - x CoO 2 + x Li + + x e |
| Reducción (cátodo): | x Li + + x C 6 + x e | ⟶ | x LiC |
| en general: | LiCo 2 + x C 6 | ⟶ | Li 1 - x CoO 2 + x LiC 6 |
(x no es más de aproximadamente 0.5.) El voltaje de la batería es de aproximadamente 3.7 V.
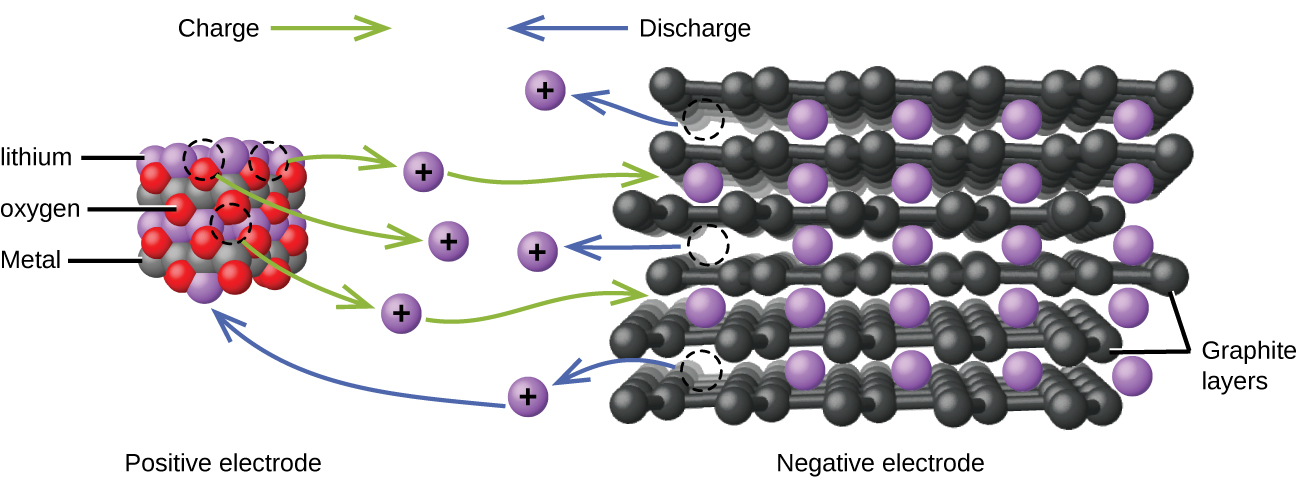
Las baterías de litio son populares porque pueden proporcionar una gran cantidad de corriente, son más ligeras que las baterías comparables de otros tipos, producen un voltaje casi constante a medida que se descargan y solo pierden lentamente su carga cuando se almacenan.
Pilas de combustible D41.5
Supongamos que se construye una celda voltaica de tal manera que la sustancia que se oxida en el ánodo y la sustancia que se reduce en el cátodo (los reactivos en la reacción redox general) se suministran de manera continua. Tal batería nunca se agotaría porque las concentraciones de reactivos o las presiones parciales nunca disminuirían. Dicho dispositivo es una pila de combustible, que produce electricidad siempre y cuando haya combustible disponible. Las pilas de combustible de hidrógeno se han utilizado para suministrar energía a satélites, cápsulas espaciales, automóviles, embarcaciones y submarinos (Figura 8).
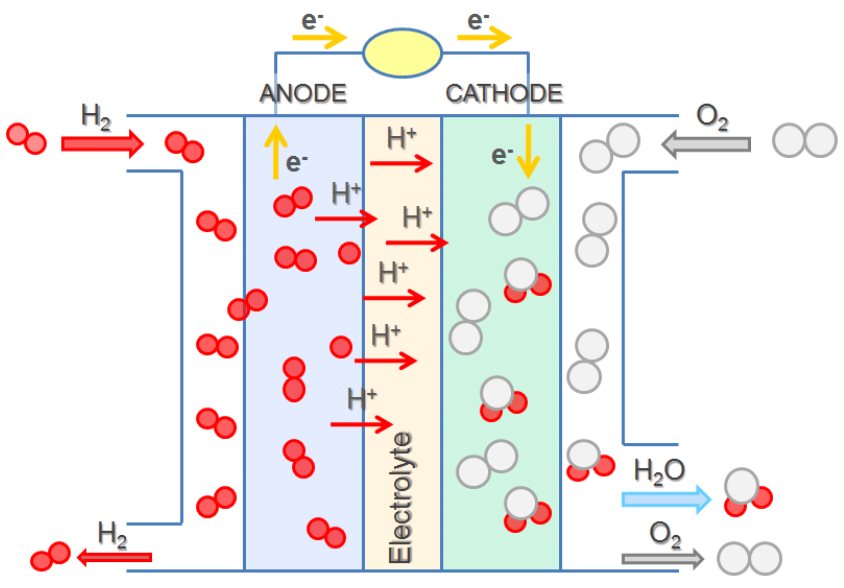
En una celda de combustible de intercambio de protones de hidrógeno-oxígeno, el potencial de la celda es de aproximadamente 1 V, y las reacciones involucradas son:
| Oxidación (ánodo): | 2 × (H 2 (g) | ⟶ | 2H + (aq) + 2e) |
| Reducción (cátodo): | O 2 (g) + 4H + (aq) + 4e | ⟶ | 2H 2 O (l) |
| en general: | O 2 (g) + 2H 2 (g) | ⟶ | 2H 2 O (l) |
La eficiencia de las celdas de combustible es típicamente de aproximadamente 40-60%, que es mayor que el típico motor de combustión interna (25-35%). Además, en el caso de la pila de combustible de hidrógeno, se produce agua casi pura como escape. Actualmente, las pilas de combustible son comparablemente más caras y contienen características que pueden causar una mayor tasa de fallas.
Pregunta Podia
Considera esta gráfica, que muestra el potencial celular en el eje vertical y la fracción de reactivos restantes (vida de la batería restante) en el eje horizontal para una batería comercial.
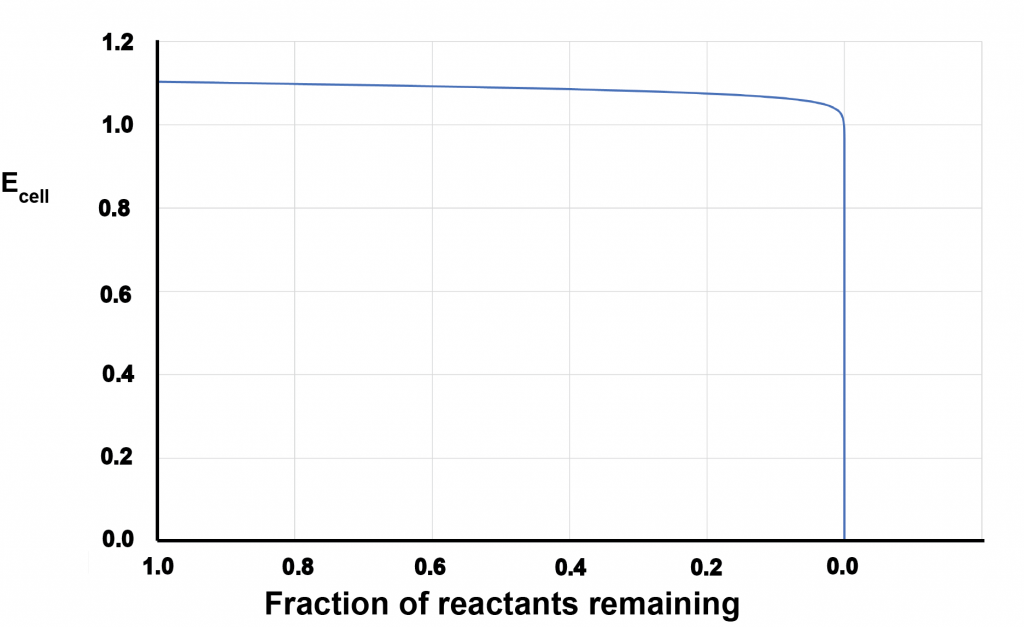
- Escribir una explicación en lenguaje científico apropiado de por qué la gráfica tiene la forma que tiene.
- Describa por qué la forma de esta gráfica es una característica positiva cuando las baterías alimentan dispositivos como teléfonos inteligentes y computadoras portátiles.
Dos días antes de la próxima sesión de toda la clase, esta pregunta de Podia se pondrá en vivo en Podia, donde podrás enviar tu respuesta.


