1.1: Introducción a la Spectoscopia
- Page ID
- 79144
La estructura de un compuesto tiene un gran efecto en sus propiedades. Pero, ¿cómo sabemos cuál es esa estructura?
Los métodos más útiles para determinar la estructura molecular implican la interacción de la radiación electromagnética, o luz, con la materia. La luz visible, la radiación ultravioleta e infrarroja, e incluso las microondas y las ondas de radio interactúan con la materia. Cada uno puede decirnos diferentes tipos de información sobre los materiales con los que interactúan.
¿Cómo interactúa la luz con la materia?
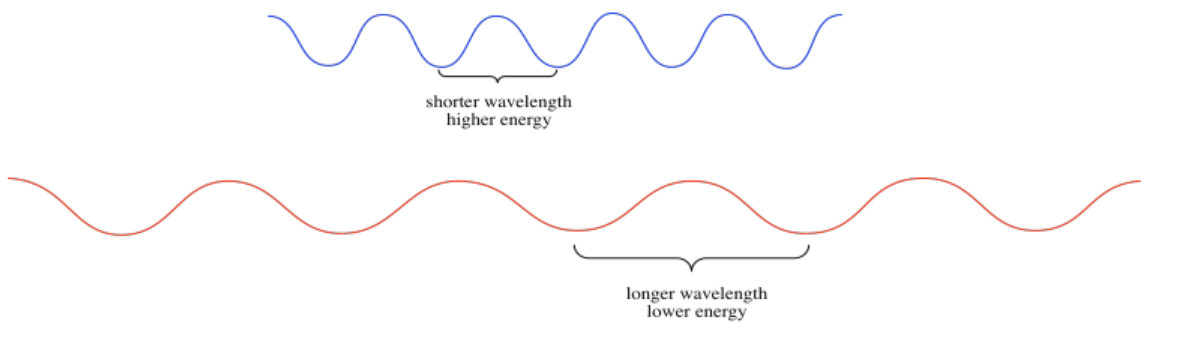
La luz tiene propiedades de olas, muy parecidas a las olas que se pueden ver en la orilla del océano. En física, las ondas pueden describirse de varias maneras diferentes. Las olas tienen amplitud: hay olas que se elevan muy altas, y otras que son bajas. Las ondas también tienen longitud de onda: pueden tener longitudes de onda largas, con grandes distancias desde el pico de una onda hasta el pico de la que viene detrás de ella. Pueden tener longitudes de onda cortas, con una siguiendo muy de cerca a otra. La longitud de onda da lugar a una propiedad complementaria, que es la frecuencia. Cuando las olas están muy juntas, puedes verlas u oírlas estrellarse contra la orilla con mucha frecuencia. Cuando están más separados, parecen chocar a la orilla con una frecuencia mucho menor.
Los diferentes colores de luz que vemos tienen diferentes longitudes de onda; la luz azul tiene una longitud de onda más corta que la luz roja, por ejemplo. Estas diferentes longitudes de onda de luz tienen diferentes cantidades de energía. Esta idea se describe en la relación Planck-Einstein:
\[E= h \nu \nonumber\]
(donde E = energía, h = constante de Planck, n = frecuencia)
o
\[E = \frac{hc}{\lambda} \nonumber\]
(donde c = velocidad de la luz, λ = longitud de onda)
Esta ecuación significa:
- Las frecuencias de luz más altas son más energéticas que las de menor frecuencia (cuando el número ν se hace más grande, el número E también aumenta).
- Las frecuencias más altas corresponden a longitudes de onda más cortas (así que cuando la longitud λ se alarga, E se vuelve más pequeña).
Hay un par de puntos importantes y sorprendentes sobre la interacción de los fotones con la materia:
- La luz se cuantifica; viaja en paquetes, llamados fotones, y diferentes fotones tienen cantidades específicas de energía.
- También se cuantifica la absorción de luz por la materia; solo paquetes específicos o “cuantos” pueden ser absorbidos por un material específico.
- En consecuencia, los compuestos específicos absorben frecuencias específicas de luz y no absorben otras.
Cuando se absorbe la luz ultravioleta y visible, la energía de la luz se transfiere a un electrón. El electrón se excita a un nivel de energía superior. Solo ciertos niveles de energía están disponibles en un material, por lo que el material solo puede absorber ciertos fotones. Eso significa:
- No se absorbe un fotón con energía insuficiente para alcanzar otro nivel de energía.
- Tampoco se absorbe un fotón con demasiada energía para alcanzar otro nivel de energía; el electrón no puede absorber parte de la energía de un fotón y tiene un poco de sobra para después.
- La longitud de onda o frecuencia de un fotón que es absorbido por el electrón corresponde a la cantidad de energía necesaria para alcanzar otro nivel de energía.
El mismo tipo de evento puede ocurrir “al revés”: un electrón puede perder energía al caer a un nivel de energía más bajo. La energía perdida puede ser entregada por el electrón como fotón de luz. La longitud de onda o frecuencia del fotón corresponde a la diferencia entre los niveles de energía electrónica. Este fenómeno, en el que la luz es absorbida por un material y luego se desprende de nuevo, se llama “fluorescencia”.
Hay muchos tipos de radiación electromagnética.
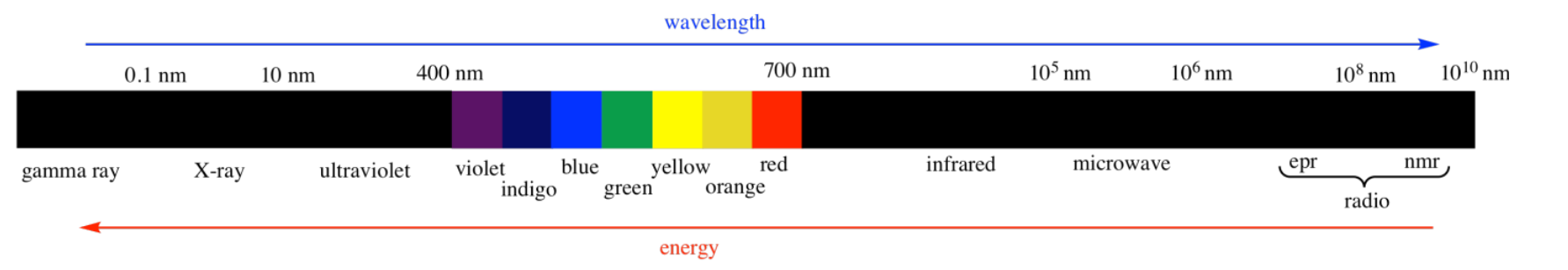
Muchos de estos tipos de “luz” pueden proporcionar diferentes tipos de información sobre la estructura. Por ejemplo:
- La espectroscopia UV-Visible nos dice algo sobre los niveles electrónicos en un material. Veremos más sobre este tipo de espectroscopía en otro capítulo. También se discute en otros lugares, en situaciones en las que se relaciona con orbitales moleculares, con compuestos de coordinación y con reacciones fotoquímicas.
- Los rayos X se pueden utilizar para construir un mapa tridimensional exacto de dónde se encuentran los átomos en un material cristalino basado en cómo los rayos X se dispersan a medida que pasan a través del cristal. La cristalografía de rayos X es un poco complicada para nosotros, sin embargo.
- Las ondas de radio interactúan con las partículas nucleares de una manera similar a la absorción de la luz UV por los electrones. Sin embargo, este fenómeno sólo ocurre en un campo magnético fuerte. La absorción de ondas de radio por los núcleos de hidrógeno en moléculas de agua en tejidos humanos se conoce como resonancia magnética (MRI). La observación de núcleos en moléculas pequeñas mediante una técnica similar se conoce como resonancia magnética nuclear (RMN). La espectroscopia de RMN será objeto de otro capítulo.
- La luz infrarroja es absorbida por diferentes enlaces en una molécula. La espectroscopia infrarroja es el tema de otro capítulo.

