3.5: Enlaces a Heteroátomos Comunes- Oxígeno
- Page ID
- 79162
Estos enlaces son bastante polares, por lo que aparecen con fuerza en la espectroscopia IR. Por lo tanto, la espectroscopia IR es una buena manera de determinar qué grupos funcionales que contienen heteroátomos están presentes en una molécula.
Compuestos que contienen enlaces simples C-O
El oxígeno forma dos enlaces. Un átomo de oxígeno se puede encontrar entre dos carbonos, como en el dibutil éter, o entre un carbono y un hidrógeno como en 1-butanol. El dibutil éter es un ejemplo de un éter y el 1-butanol es un ejemplo de un alcohol.
Si nos fijamos en un espectro IR de dibutil éter, verá:
- existen los modos habituales de estiramiento sp 3 C-H y flexión CH 2 a 2900 y 1500 cm -1.
- hay un pico fuerte cerca de 1000 cm -1. Este pico se debe a la vibración de estiramiento C-O.
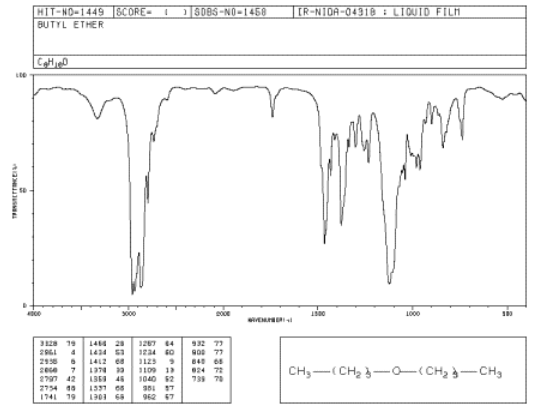
Fuente: SDBSWeb: http://riodb01.ibase.aist.go.jp/sdbs/ (Instituto Nacional de Ciencia y Tecnología Industrial Avanzada de Japón, 14 de julio de 2008)
Si miras un espectro IR de 1-butanol, verás:
- hay modos de estiramiento sp 3 C-H y flexión CH 2 a 2900 y 1500 cm -1.
- hay un fuerte modo de estiramiento C-O cerca de 1000 cm -1.
- hay un pico muy grande alrededor de 3400 cm -1. Los picos O-H suelen ser muy amplios como este.
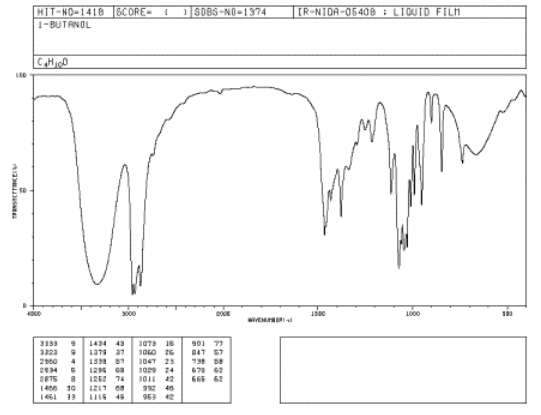
Fuente: SDBSWeb: http://riodb01.ibase.aist.go.jp/sdbs/ (Instituto Nacional de Ciencia y Tecnología Industrial Avanzada de Japón, 14 de julio de 2008)
Las formas de los picos a veces son muy útiles para reconocer qué tipo de vínculo está presente. La forma redondeada de la mayoría de los modos de estiramiento O-H ocurre debido a los enlaces de hidrógeno entre diferentes grupos hidroxi. Debido a que los protones se comparten en medida variable con los oxígenos vecinos, los enlaces O-H covalentes en una muestra de alcohol vibran a frecuencias ligeramente diferentes y se muestran en posiciones ligeramente diferentes en el espectro IR. En lugar de ver un pico agudo, ves muchos de ellos todos manchados en una mancha ancha. Dado que los enlaces C-H no hacen enlaces de hidrógeno muy bien, no se ve ese fenómeno en un éter, y un pico O-H es muy fácil de distinguir en el espectro IR.
Aunque solo hay dos enlaces C-O en el dibutil éter, el modo de estiramiento C-O es aún más fuerte que el pico a 2900 cm -1 que surge de 10 enlaces C-H diferentes. Explique por qué.
- Contestar
-
El enlace C-O es mucho más polar que el enlace C-H. Los enlaces más polares absorben la luz IR mucho más fuertemente que los menos polares o no polares.
El espectro IR del metil fenil éter (también conocido como anisol) tiene fuertes picos a 1050 y 1250 cm -1.

- Identificar el tipo de enlace correspondiente a estos dos picos.
- ¿Por qué hay dos picos para este tipo de enlace en esta molécula, y no solo uno?
- Dibujar una segunda estructura de resonancia zwitteriónica para metil fenil éter.
- Utilice la estructura de resonancia zwitteriónica para explicar por qué uno de estos enlaces aparece a una frecuencia mayor que el otro.
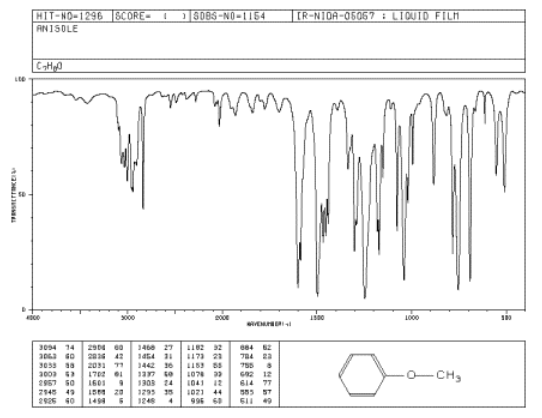
Figura\(\PageIndex{3}\): Espectro IR de metil fenil éter.
Fuente: SDBSWeb: http://riodb01.ibase.aist.go.jp/sdbs/ (Instituto Nacional de Ciencia y Tecnología Industrial Avanzada de Japón, 14 de julio de 2008)
- Contestar
-
a) Estos picos corresponden a tramos C-O.
b) Hay dos enlaces C-O distinguibles: uno es un enlace C sp 2-O entre el oxígeno y el aromático; el otro es un enlace C sp 3-O entre el oxígeno y el grupo metilo alifático.
c) El enlace al aromático tiene algún carácter de doble enlace debido a la conjugación.
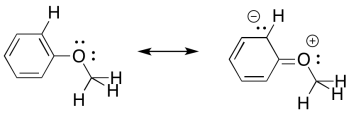
d) El carácter de doble enlace parcial significa que el enlace C sp 2-O es un poco más fuerte que el enlace C sp 3-O y por lo tanto el enlace C sp 2-O se muestra a una frecuencia mayor.

