4.6: Más sobre Efectos Electrónicos
- Page ID
- 79130
El metoxibenceno o anisol tiene seis carbonos, pero solo cuatro picos en el espectro debido a la simetría. Estos picos están todos por encima de 100 ppm, pero algunos picos están tan abajo como 160 ppm.
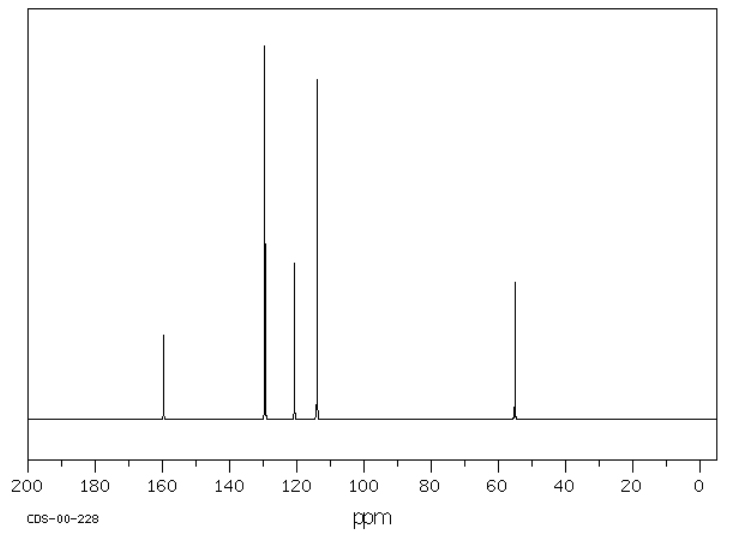
Fuente: SDBSWeb: http://riodb01.ibase.aist.go.jp/sdbs/ (Instituto Nacional de Ciencia y Tecnología Industrial Avanzada de Japón, 15 de agosto de 2008)
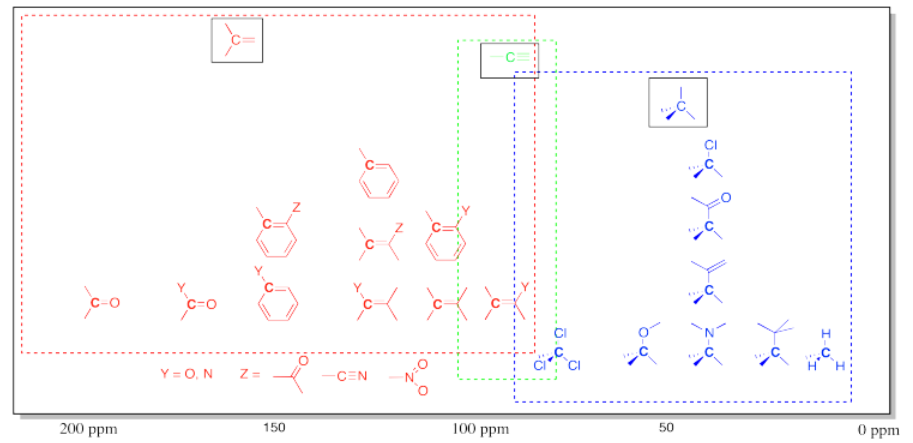
- por lo general, un carbono plano trigonal aparece en la mitad abajo del espectro.
- la región de aproximadamente 100 a 200 ppm puede ser considerada como la ventana sp 2.
- un átomo electronegativo mueve un pico más abajo dentro de la ventana sp 2.
El benzaldehído tiene picos entre 130 y 140 ppm, así como uno cercano a 190 ppm. Al igual que en la región sp 3 del espectro, cuando un carbono está unido a un elemento electronegativo, se mueve más abajo, y dado que el carbono carbonilo (o C=O) en el aldehído tiene dos enlaces al oxígeno, se muestra considerablemente campo abajo. El carbono carbonílico en algunas cetonas puede aparecer hasta 210 ppm.
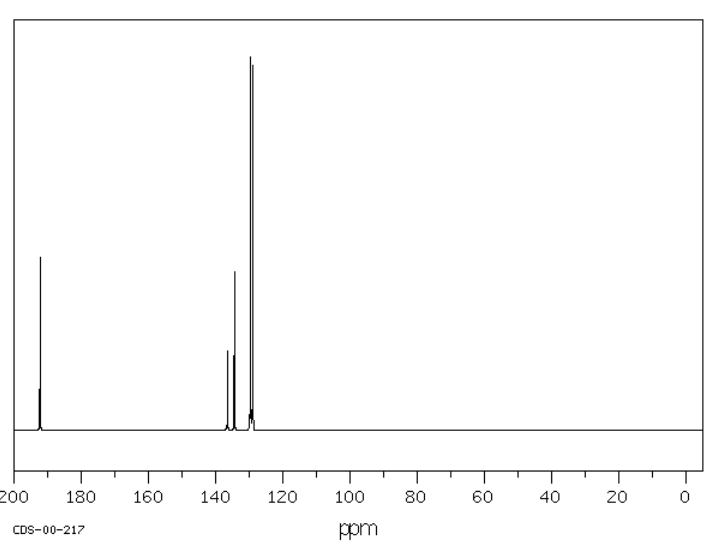
Fuente: SDBSWeb: http://riodb01.ibase.aist.go.jp/sdbs/ (Instituto Nacional de Ciencia y Tecnología Industrial Avanzada de Japón, 15 de agosto de 2008)
- Los carbonos carbonílicos pueden aparecer incluso más abajo que 200 ppm.
- Los carbonos carbonílicos tienen una gran cantidad de carga positiva y baja densidad de electrones.
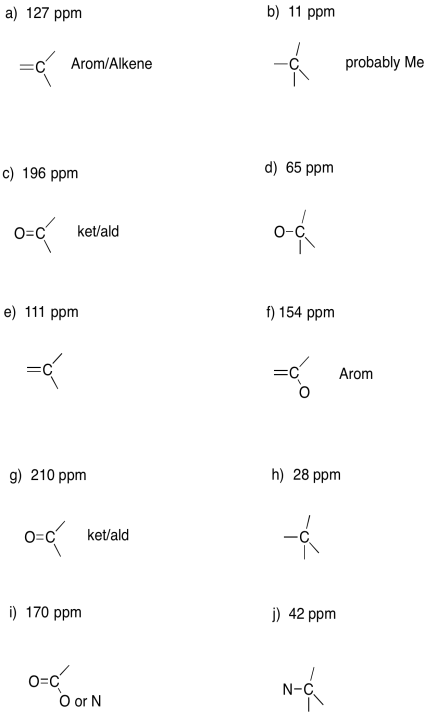
Sugiere posibles asignaciones para los siguientes cambios químicos en un espectro de RMN de 13 C.
a) 127 ppm b) 11 ppm c) 196 ppm d) 65 ppm e) 111 ppm
f) 154 ppm g) 210 ppm h) 28 ppm i) 170 ppm j) 42 ppm
- Contestar
-
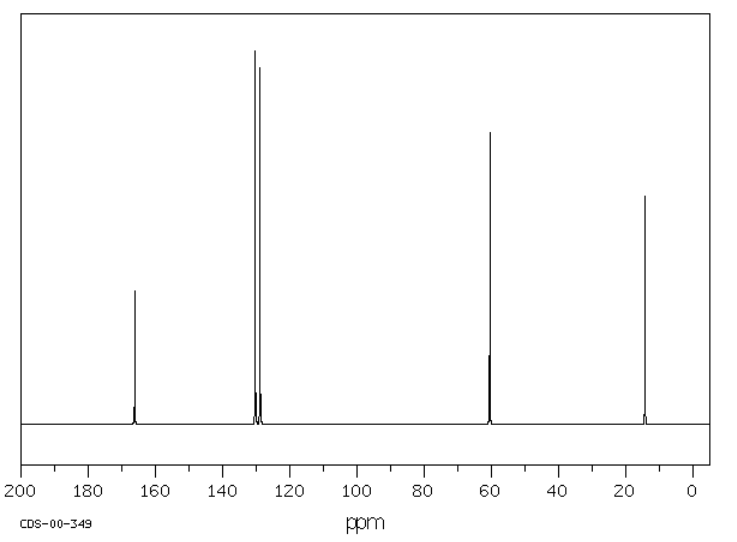
Sugerir posibles estructuras para los siguientes espectros.
Fuente: SDBSWeb: riodb01.ibase.aist.go.jp/sdbs/ (Instituto Nacional de Ciencia y Tecnología Industrial Avanzada de Japón, 19 de agosto de 2008)
a)
b)
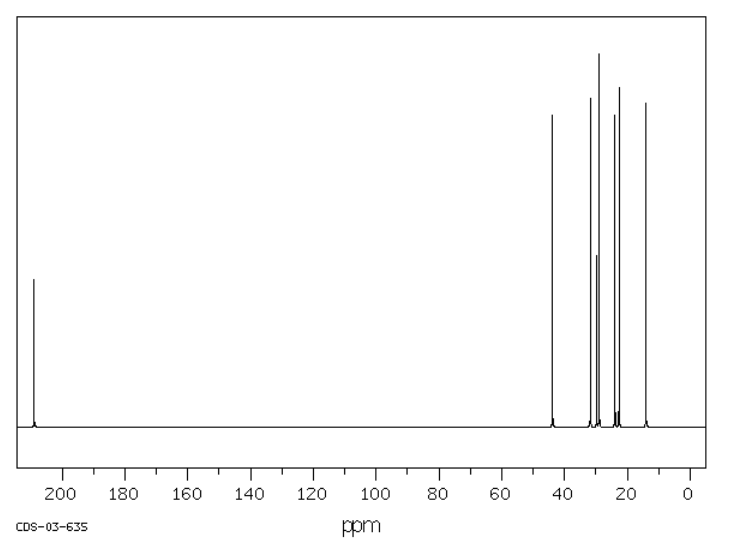
c)
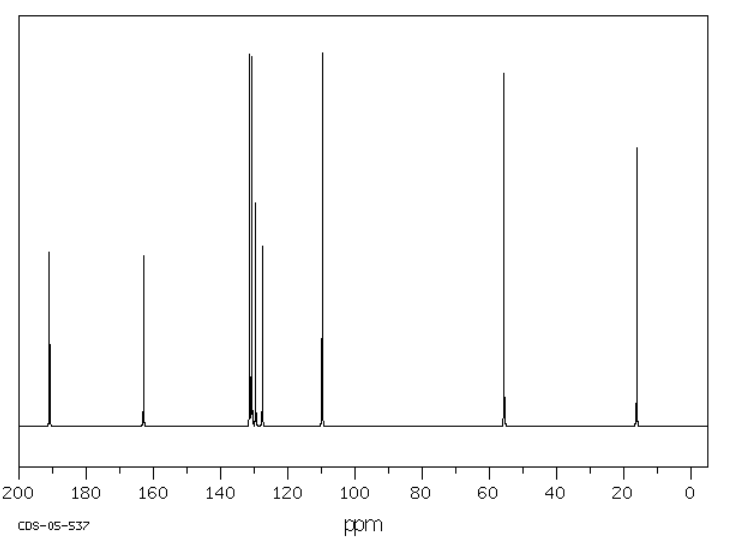
- Contestar
-
Hay sutiles efectos de electronegatividad en hidrocarburos saturados como el hexano. Los carbonos en diferentes posiciones en esos compuestos se muestran en diferentes turnos. En general, un grupo metilo (CH 3) se mostrará más arriba que un grupo metileno (CH 2), que a su vez aparecerá más arriba de un grupo metino (CH). Esta tendencia está relacionada con la diferencia de electronegatividad entre un carbono y un hidrógeno. El carbono es un poco más electronegativo que un hidrógeno. Como resultado, un átomo de carbono que está unido a varios átomos de hidrógeno tiene una carga negativa muy ligera. Eso significa que absorbe más en la parte alta. Un carbono que está unido a una serie de carbonos es más neutro, no está tan blindado y aparece un poco más abajo.
A menos que haya mayores efectos electronegativos debido a heteroátomos como el oxígeno,
- los grupos metilo (CH 3) aparecen en el campo más alto.
- los grupos metileno (CH 2) aparecen al lado más alto del campo.
- los grupos de metino (CH) aparecen más abajo.
Podemos utilizar la espectroscopia de RMN como herramienta de diagnóstico para determinar la estructura de un compuesto. 13 La espectroscopia de RMN C es útil para resaltar si hay algún doble enlace en una molécula, si hay algún heteroátomo como el oxígeno, y cuántos tipos diferentes de carbonos hay. Ese último punto no es lo mismo que el número de carbonos, sino que está relacionado con la simetría de la molécula.
Cuadro\(\PageIndex{1}\): Desplazamientos químicos aproximados en espectroscopía de RMN 13 C.