4.5: Factores en el Cambio Químico- Electronegatividad
( \newcommand{\kernel}{\mathrm{null}\,}\)
La electronegatividad es un segundo factor que influye en los espectros de RMN. La frecuencia de las ondas de radio absorbidas por un átomo depende del campo magnético experimentado en el núcleo. El campo magnético experimentado en el núcleo depende de la cantidad de densidad de electrones alrededor del átomo. En consecuencia:
- cuanto más densidad de electrones presente, más campo arriba será el cambio en el espectro.
- cuanto menor sea la densidad de electrones presente alrededor del átomo, más abajo será el cambio.
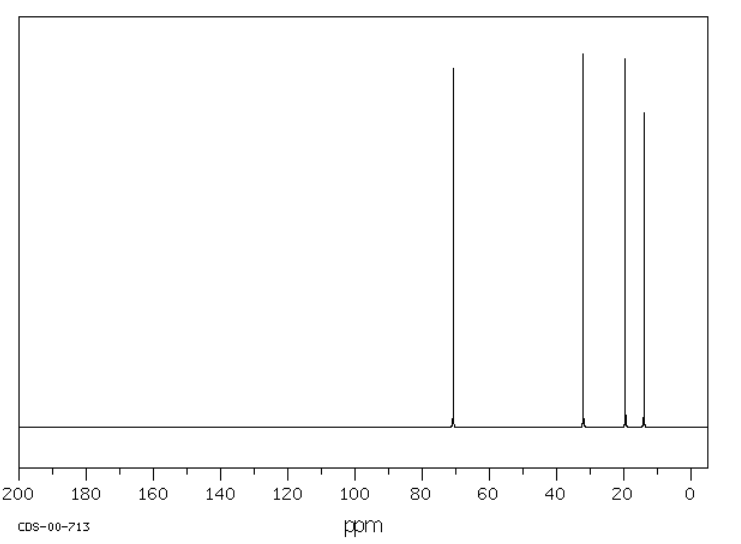
La tributilamina tiene un espectro de RMN con cuatro picos, uno por cada carbono inequivalente en la estructura. Estos picos se extienden un poco más que en un hidrocarburo; hay más picos que aparecen más abajo. El carbono al lado del nitrógeno es el que se muestra más abajo.
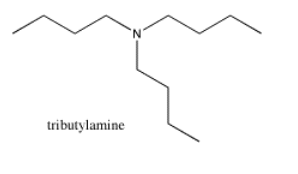
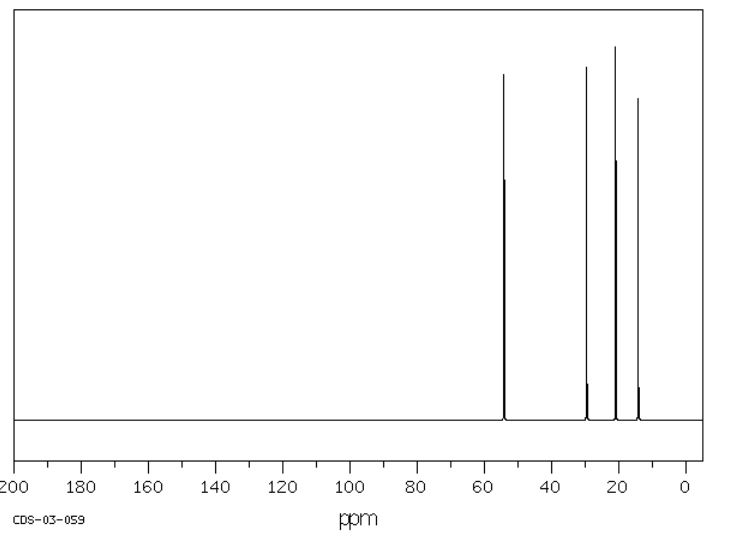
Fuente: SDBSWeb: http://riodb01.ibase.aist.go.jp/sdbs/ (Instituto Nacional de Ciencia y Tecnología Industrial Avanzada de Japón, 15 de agosto de 2008)
- por lo general, un carbono tetraédrico aparece en la mitad alta del espectro.
- la región de aproximadamente 0 a 100 ppm puede considerarse como la ventana sp 3.
- un átomo electronegativo mueve un pico más abajo dentro de la ventana sp 3.
El éter de dibutilo tiene picos que aparecen aún más abajo. Al igual que en la tributilamina, el carbono al lado del heteroátomo, en este caso un oxígeno, muestra el campo más lejano. Los otros carbonos de la cadena también aparecen un poco más abajo de lo que lo harían en el butano, pero cuanto más alejados del oxígeno están, menos efecto tiene el oxígeno sobre ellos. Este es un típico efecto inductivo. En un efecto inductivo, los átomos tienen un efecto entre sí a través de enlaces sigma, pero cuanto más separados están los átomos, menor es el efecto.
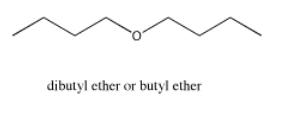
Fuente: SDBSWeb: http://riodb01.ibase.aist.go.jp/sdbs/ (Instituto Nacional de Ciencia y Tecnología Industrial Avanzada de Japón, 15 de agosto de 2008)
Observe que la absorbancia de un carbono próximo a un átomo de oxígeno se desplazó aún más hacia la izquierda que un carbono próximo a un átomo de nitrógeno. Cuanto más electronegativo es el vecino, mayor es el efecto. Probablemente esperarías que un vecino menos electronegativo que el carbono resultara en un cambio hacia la derecha, y generalmente ese es el caso.
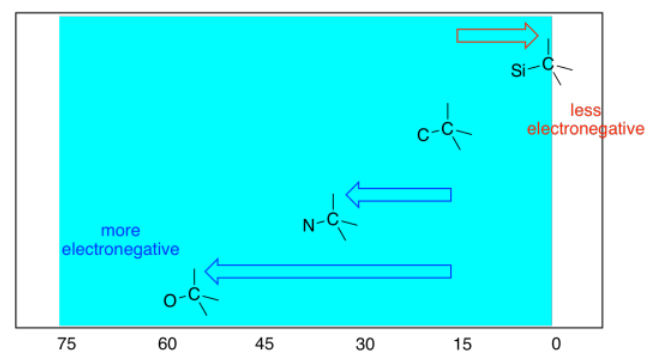
En resumen:
- elementos electronegativos dibujan carbonos unidos campo abajo.
- cuanto más electronegativo sea el elemento, más abajo será el carbono unido.
- Los elementos electronegativos también tienen un efecto sobre los átomos más abajo de la cadena, dibujándolos campo abajo.
- cuanto más lejos está el átomo del átomo electronegativo, menor es el efecto.
- el efecto de los átomos electronegativos en sus vecinos se denomina efecto inductivo.
El metano (CH 4) absorbe a aproximadamente 5 ppm en el espectro de RMN de 13 C. El clorometano absorbe a aproximadamente 30 ppm. Dado que el cloro es casi tan electronegativo como el nitrógeno, el efecto de un cloro o un nitrógeno sobre un carbono unido son similares.
El diclorometano o cloruro de metileno (CH 2 Cl 2) aparece a aproximadamente 55 ppm, y el triclorometano o cloroformo (CHCl 3) a aproximadamente 80 ppm. Cuantos más enlaces haya a un elemento electronegativo, más abajo absorbe el carbono. En el caso de un carbono clorado, cada cloro adicional mueve el pico aproximadamente 25 ppm más abajo.
- el efecto de la electronegatividad es aditivo.
- cuantos más elementos electronegativos estén unidos a un carbono, más abajo absorbe.
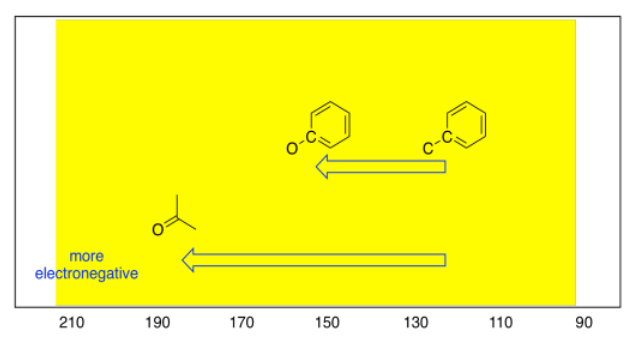
Estas tendencias también se observan entre los carbonos sp 2. Un átomo de oxígeno unido a un carbono sp 2 da como resultado un cambio de campo abajo, a aproximadamente 160 ppm. Por otro lado, si un carbono plano trigonal está doblemente unido a un átomo de oxígeno, el desplazamiento puede ser mucho más lejos; en realidad oscila entre 160 y 210 ppm, dependiendo de qué más esté unido al carbono, y se ve más comúnmente alrededor de 180 ppm.
Sugerir una asignación para los siguientes 13 picos de RMN C:
a) 12 ppm b) 58 ppm c) 22 ppm d) 41 ppm
- Contestar
-

Dibuje los espectros de RMN de 13 C previstos para los siguientes compuestos.
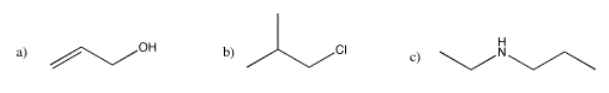
- Contestar
-