4.8: Desplazamiento químico en espectros de protones
- Page ID
- 79138
Las tendencias aquí son exactamente las mismas que en los espectros de carbono. Dondequiera que vaya el carbono, lleva consigo el protón. Los espectros de protones tienen solo alrededor de 10 ppm de ancho, en comparación con los 200 ppm de espectros de carbono, por analogía con los espectros de carbono,
- los hidrógenos en los carbonos sp 3 suelen aparecer en la mitad alta del espectro, aproximadamente de 0 a 5 ppm.
- los hidrógenos en los carbonos sp 2 suelen aparecer en la mitad del espectro, aproximadamente de 5 a 10 ppm.
- dentro de estas dos mitades del espectro, los átomos electronegativos unidos al mismo carbono que un protón atraerán ese protón campo abajo.
Entonces, en el espectro del hexano (CH 3 CH 2 CH 2 CH 2 CH 2 CH 3) todos los hidrógenos están en carbonos sp 3 o tetraédricos. Todos aparecen por debajo de 5 ppm. No hay átomos electronegativos alrededor, por lo que están aún más arriba, a 1 ppm.
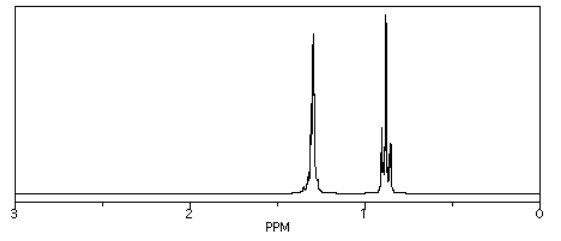
Fuente: Espectro simulado.
Esos picos caen bien dentro de la ventana esperada.
Si observamos el 1-hexeno (CH 2 =CHCH 2 CH 2 CH 2 CH 3), vemos un espectro similar, pero dos de los picos se muestran por encima de 5 ppm. Estos hidrógenos están en carbonos planos sp 2 o trigonales. Hay otros cambios, más sutiles, pero ese es el principal.
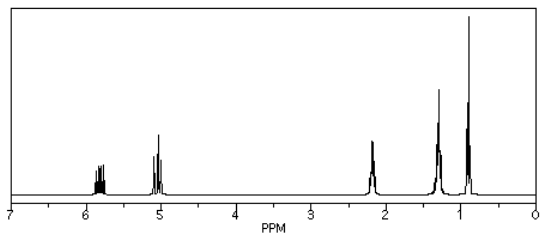
Fuente: Espectro simulado.
Nuevamente, los nuevos picos caen justo alrededor de donde los esperaríamos.
Los cambios de electronegatividad que vimos antes de los espectros de RMN 13C también son ciertos para los espectros 1H. Cuanto más electronegativo sea el vecino del carbono sobre el que se asienta el protón, más se desplazará el protón hacia la izquierda en el espectro.
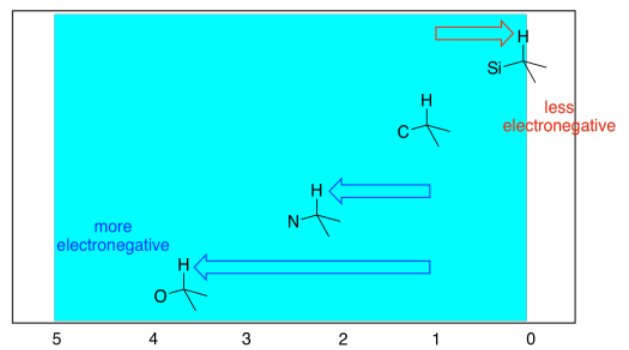
Puede ser útil pensar en 1 ppm como la posición predeterminada para un protón sobre un carbono tetraédrico, y pensar en los efectos de otros grupos como alejar el pico a cierta distancia de ese punto de partida. Por ejemplo, un átomo de oxígeno vecino mueve el pico 2.5 ppm hacia la izquierda. Pensarlo de esa manera te ayuda a predecir cuál será el efecto de dos grupos unidos diferentes. Por ejemplo, si hubiera dos oxígenos adheridos al carbono sobre el que se encuentra el protón, se movería 5 ppm, y terminaría en 6 ppm en general.
Al igual que en la espectroscopia de RMN 13C, hay efectos más sutiles de tener vecinos de carbono sp 2 cerca. Una vez más, eso es por el efecto que tiene el campo magnético sobre los electrones en el doble enlace.
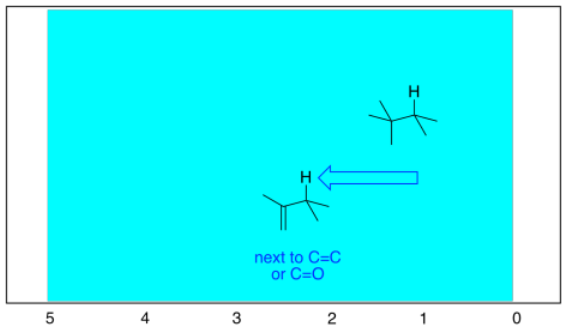
Vemos tendencias similares en la región de la izquierda, sp 2. Si observamos el butanal (CH 3 CH 2 CH 2 CHO), también tenemos varios hidrógeno en los carbonos sp 3 y uno en un carbono sp 2. Los primeros se muestran por debajo de 5 ppm y los segundos por encima de 5 ppm. Esta vez, ese pico está muy abajo a 10 ppm. Ese hidrógeno está en un carbono carbonilo; al estar doble enlazado a un oxígeno se deshiele el carbono, y su socio hidrógeno mucho.
Fuente: Espectro simulado.
Como antes, también hay hidrógenos en carbonos lineales o sp, aunque son mucho menos comunes que los carbonos tetraédricos o trigonales.
- los hidrógenos en los carbonos sp aparecen entre 2 y 6 ppm, y la mayoría de las veces entre 2 y 3 ppm.
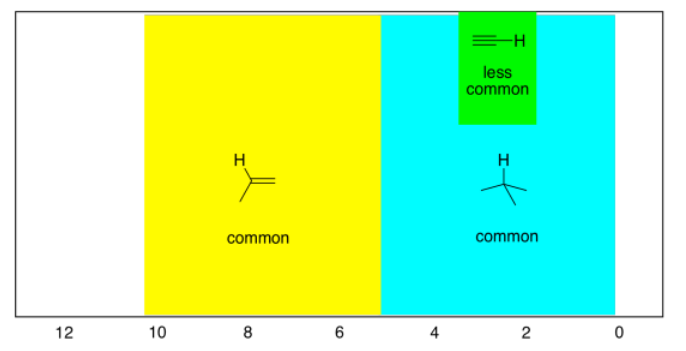
Recuerda, estas son reglas generales que debes conocer. El protón en cloroformo se presenta a 7 ppm aunque está unido a un carbono tetraédrico, debido a que tiene tres cloros electronegativos diferentes tirando de él hacia la izquierda. (Los cambios récord mundiales ocurren para los hidrógenos unidos a los metales de transición: los metales “tardíos” como el rutenio o el rodio pueden mover los picos de hidrógeno hasta -20 ppm, pero los metales “tempranos” como el tántalo pueden moverlos hasta 25 ppm).
Una palabra de precaución: los estudiantes a menudo se dan cuenta de la regla de la electronegatividad e inmediatamente hacen suposiciones sobre los grupos OH que resultan no ser ciertas. La conclusión obvia hasta ahora es que los grupos OH siempre deben aparecer en la mano izquierda del espectro, porque el hidrógeno está directamente unido a ese oxígeno muy electronegativo. Eso a veces puede ser cierto: el protón en un ácido carboxílico, si se puede ver en el espectro, generalmente aparece alrededor de 12 ppm. Sin embargo, el protón en el agua suele rondar 1.5 ppm. De hecho, los protones en grupos OH en situaciones ligeramente diferentes cubren todo el rango del espectro protónico.
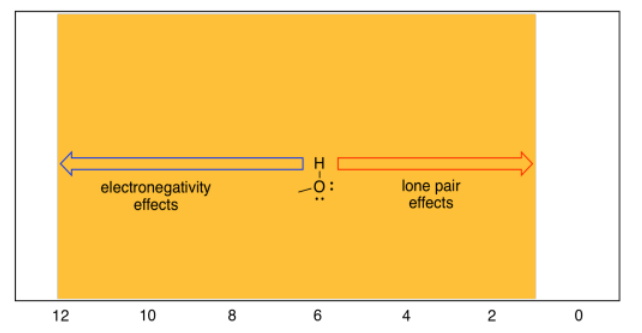
La razón de este amplio rango tiene que ver con el hecho de que, aunque el oxígeno es muy electronegativo (por lo que su hidrógeno vecino debería ser pobre en electrones) también posee pares solitarios. Esos pares solitarios tienen el efecto de proteger el hidrógeno del campo magnético. Así, hay dos efectos que compiten en los protones OH, y diferentes situaciones inclinan la balanza de una manera u otra.
Indicar si cada uno de los siguientes picos en el espectro de RMN 1H probablemente representa un hidrógeno en un carbono tetraédrico (H-C sp 3) o un hidrógeno en un carbono plano trigonal (H-C sp 2).
a) 1.1 ppm b) 3.4 ppm c) 7.8 ppm d) 4.2 ppm e) 5.7 ppm f) 9.9 ppm g) 2.3 ppm
- Contestar
-
a) H-C sp 3 b) H-C sp 3 c) H-C sp 2 d) H-C sp 3 e) H-C sp 2 f) H-C sp 2 g) H-C sp 3
Los siguientes picos en el espectro de RMN 1H representan átomos de hidrógeno en carbonos tetraédricos (H-C sp 3). Indicar si ese carbono probablemente está unido a otro carbono tetraédrico, un oxígeno o un nitrógeno.
a) 1.1 ppm b) 1.9 ppm c) 2.5 ppm d) 4.2 ppm e) 1.8 ppm f) 3.6 ppm g) 2.7 ppm
- Contestar
-
a) carbono b) carbono c) nitrógeno d) oxígeno e) carbono f) oxígeno g) nitrógeno
Aunque el C-H aromático y el alqueno C-H están ambos unidos a carbonos sp2, los siguientes picos en el espectro de RMN de 1H probablemente representan átomos de hidrógeno en carbonos de alqueno o carbonos aromáticos.
a) 7.3 ppm b) 8.3 ppm c) 5.1 ppm d) 6.2 ppm e) 5.4 ppm f) 7.8 ppm
- Contestar
-
a) aromático b) aromático c) alqueno d) alqueno e) alqueno f) aromático
Los siguientes picos en el espectro de RMN 1H representan átomos de hidrógeno en carbonos planos trigonales (H-C sp 2). Indicar si ese carbono probablemente está unido a otro carbono plano trigonal en un anillo aromático, está unido de manera simple a un nitrógeno en un anillo aromático, o está unido por doble enlace a un oxígeno.
a) 7.1 ppm b) 6.9 ppm c) 8.5 ppm d) 10.2 ppm e) 9.8 ppm f) 8.2 ppm g) 7.9 ppm
- Contestar
-
a) H-C Ar -C b) H-C Ar -C c) H-C Ar -N d) C=O e) C=O f) H-C Ar -N g) H-C Ar -N
Al observar los espectros de RMN 1H de los siguientes compuestos, se indica qué pico pertenece a qué protón.
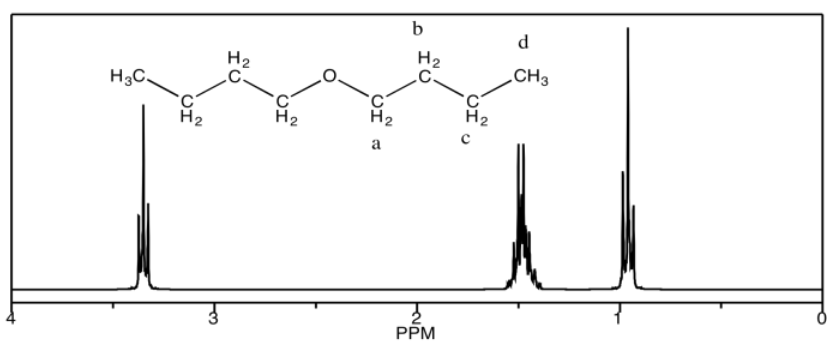
a) dibutil éter
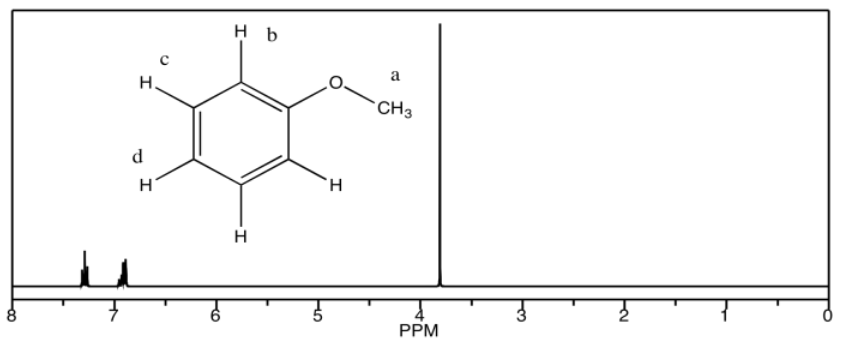
b) metil fenil éter
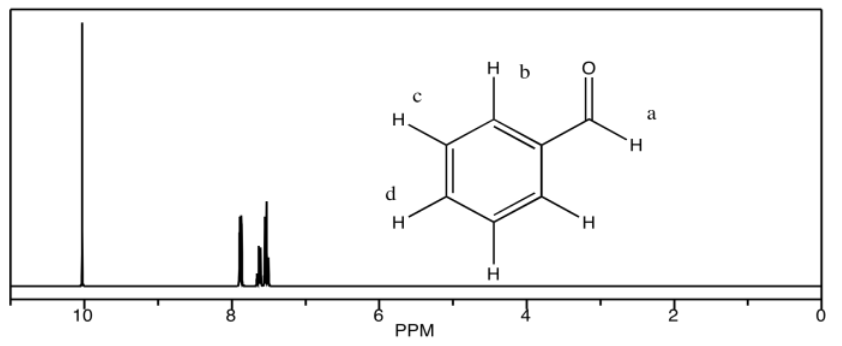
c) benzaldehído
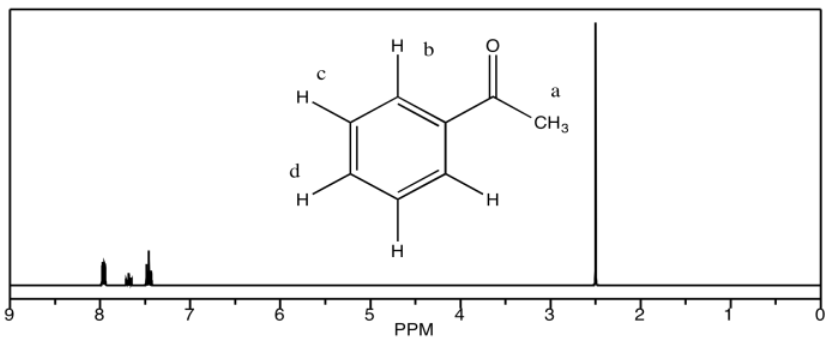
d) acetofenona
- Contestar
-
a) 3.4 ppm: H a 1.5 ppm: H b, H c 0.9 ppm: H d
b) 7.4 ppm: H d 6.9 ppm: H b, H c 3.7 ppm: H a
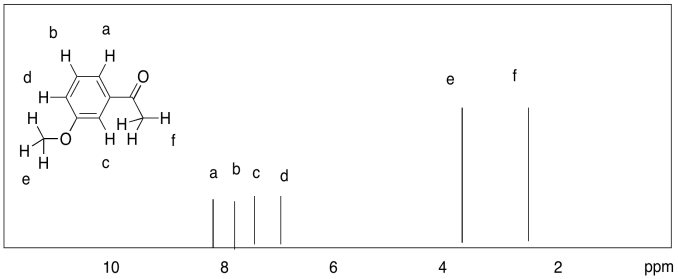
c) 10.1 ppm: H a 7.9 ppm: H b 7.6 ppm: H d 7.5 ppm: H c
d) 7.9 ppm: H b 7.6 ppm: H d 7.4 ppm: H c 2.5 ppm: H a
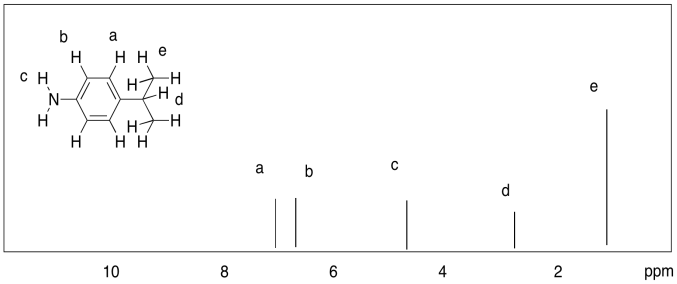
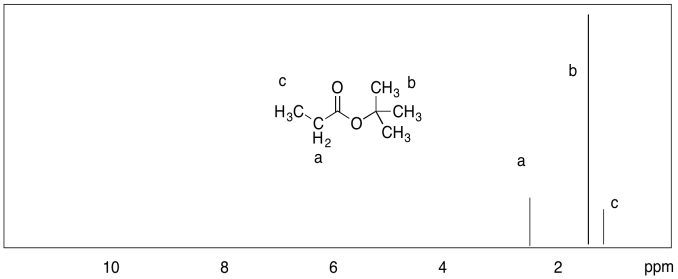
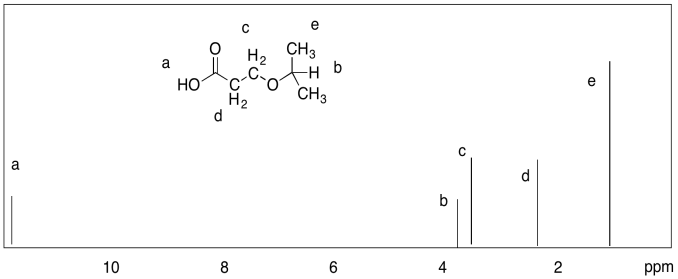
Esbozar un espectro de RMN de 1H para cada uno de los siguientes compuestos, mostrando una línea simple correspondiente al desplazamiento esperado para cada uno de los diferentes hidrógenos.
- Contestar
-
a)
b)
c)
d)
Observe que una diferencia importante con la RMN de 13 C es que un espectro de carbono se extiende sobre 200 ppm, mientras que un espectro de protones típico se comprime en aproximadamente 10 ppm. Hay una consecuencia de esa diferencia, y puede ser frustrante. Por lo general, es fácil distinguir dos picos diferentes de 13 C, mientras que dos picos en el espectro de 1H podrían estar tan cerca entre sí que se superponen. Por ejemplo, los hidrocarburos alifáticos hexano y nonano muestran solo dos picos distintos en el espectro 1H, uno para los hidrógenos de metilo y otro para los hidrógenos de metileno, porque estos últimos son demasiado similares para distinguirlos dada la limitada cantidad de resolución en el espectro.
- El solapamiento coincidente de los picos en el espectro 1H es común.
Existe otra complicación en los desplazamientos químicos observados en la espectroscopia 1H, y es el comportamiento de los protones unidos directamente a heteroátomos como el oxígeno y el nitrógeno. El oxígeno es muy electronegativo, y el hidrógeno no lo es, por lo que es lógico pensar que un protón OH absorbería a campo muy bajo, digamos 10 ppm. Eso está completamente equivocado. Los protones OH en alcoholes alifáticos se muestran entre 2 y 6 ppm, los protones OH fenólicos entre 5 y 9 ppm y los protones OH de ácido carboxílico entre 11 y 12 ppm. El agua aparece alrededor de 1.6 ppm cuando se disuelve en cloroformo, pero si el agua está presente en altas concentraciones puede aparecer más abajo. Así:
- un protón unido al oxígeno muestra entre 1 y 12 ppm.
- los desplazamientos de protones hidroxi pueden variar dependiendo de factores como los enlaces de hidrógeno con el disolvente y otras moléculas.
- a excepción de los protones de ácido carboxílico, que ocurren más allá del rango normal de otros picos, un pico que aparece en un desplazamiento particular no es evidencia fuerte de la presencia de un protón OH.
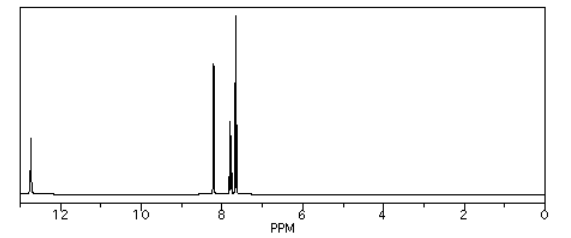
Fuente: Espectro simulado.
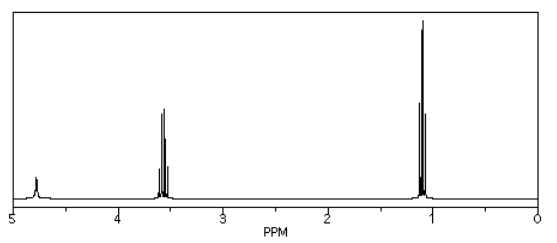
Fuente: Espectro simulado.
Aunque el oxígeno es muy electronegativo, también tiene dos pares solitarios de electrones; esos pares solitarios en oxígeno suelen ser cruciales para comprender la química. El átomo de oxígeno aleja la densidad electrónica del hidrógeno a través del enlace sigma entre ellos, pero los pares solitarios también bañan al hidrógeno cercano en los efectos de blindaje de su densidad electrónica. Dependiendo de cómo se equilibren estos dos factores, los protones OH y NH no absorben casi tan abajo como se esperaba.

