4.19: Apéndice
- Page ID
- 79108
T capaz de 13 frecuencias de RMN C Común en Compuestos Orgánicos.
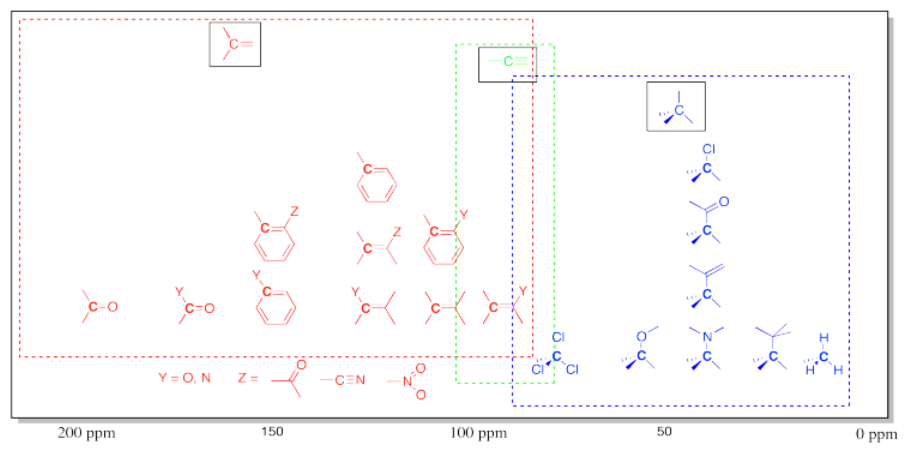
Tenga en cuenta que los efectos son aditivos: dos o más grupos aceptores de electrones mueven la absorbancia más hacia la izquierda que solo un grupo.
T capaz de 1 H NMR Frecuencias Comunes en Compuestos Orgánicos.
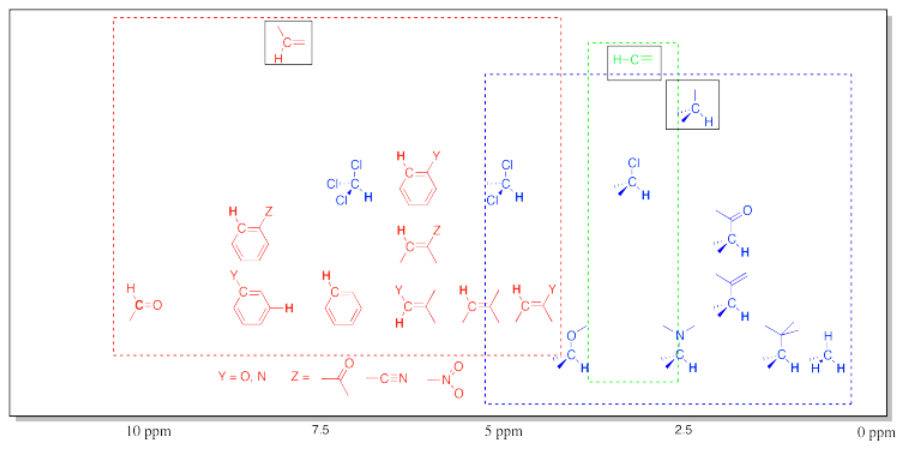
En este gráfico se muestran las frecuencias de protones que están adheridos a los carbonos. En general, los protones siguen la tendencia que se ve en el carbono al que están apegados. Obsérvese nuevamente los efectos aditivos de múltiples grupos unidos.
Esta tabla no incluye protones OH (o NH). Los protones unidos a los heteroátomos son más difíciles de identificar porque sus ubicaciones en el espectro son mucho menos específicas. En cambio, se pueden encontrar en una gama muy amplia.
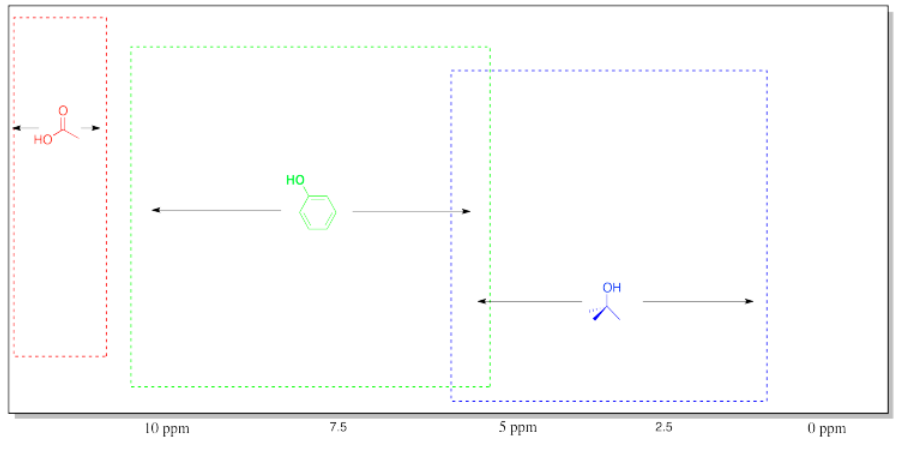
T capaz de 1 H NMR Frecuencias de OH Común en Compuestos Orgánicos.
Cuadro de Algunas Impurezas Comunes en Muestras de RMN.
Las impurezas menores en el espectro de RMN son a menudo el resultado de disolventes utilizados durante una reacción o purificación de muestra. En la siguiente tabla se proporcionan algunos ejemplos, en los que se muestran los datos que verías de disolventes comunes en un espectro de RMN tomado en cloroformo.
| solvente | número de picos | turno | multiplicidad | relación integral | asignación |
| agua | 1 | 1.56 | br. s | - | O- H |
| acetona | 1 | 2.17 | s | - | (C=O) C H 3 |
| cloroformo | 1 | 7.26 | s | - | Cl 3 C- H |
| t-butil metil éter | 2 | 1.19 | s | 3 | C (C H 3) 3 |
| 3.22 | s | 1 | O-C H 3 | ||
| acetato de etilo | 3 | 1.26 | t | 3 | CH 2 C H 3 |
| 2.05 | s | 3 | (C=O) C H 3 | ||
| 4.12 | q | 2 | OC H 2 CH 3 | ||
| grasa o alcanos | 2 | 0.86 | m | varía; más pequeño | CH 2 C H 3 |
| 1.26 | m | varía; más grande | CH 2 C H 2 CH 2/CH 2 C H 2 CH 3 |
Una excelente tabla, incluyendo desplazamientos de una variedad de impurezas en diferentes disolventes de RMN, se puede encontrar en el siguiente artículo: Gottlieb, H. E.; Kotlyar, V.; Nudelman, A. J. Org. Chem. 1997, 62, 7512-7515.
Tabla de Solventes
Picos Residuales
Debido a que una muestra de RMN es mayormente solvente (con una pequeña cantidad de soluto disuelto que realmente te interesa), generalmente hay un pico en el espectro que proviene de los átomos en el solvente. Por lo general, el uso de disolventes deuterados (enriquecidos en 2 H en lugar de 1 H) minimiza el tamaño de los picos de disolvente en 1H RMN. Sin embargo, siempre queda una traza de 1 H en el disolvente, que se muestra como un pequeño pico en el espectro. Los picos residuales de 13 C suelen ser mucho mayores que los picos que surgen del soluto.
| Solvente | Turno de 1 H | Multiplicidad | 13 C Turno | Multiplicidad* |
| Acetona- d 6 | 2.05 | rependió | 206.68 | cantar |
| 29.92 | sept | |||
| Acetonitrilo- d 3 | 1.94 | rependida | 118.69 | cantar |
| 1.39 | sept | |||
| Benceno- d 6 | 7.16 | cantar | 128.39 | viaje |
| Cloroformo-d | 7.27 | cantar | 77.23 | viaje |
| D 2 O | 4.80 | — | ||
| Diclorometano- d 2 | 5.32 | viaje | 54.00 | rependida |
| DMF- d 7 | 8.03 | cantar | 163.15 | viaje |
| 2.92 | rependida | 34.89 | sept | |
| 2.75 | rependida | 29.76 | sept | |
| DMSO- d 6 | 2.50 | rependida | 39.51 | sept |
| Metanol- d 4 | 4.87 | cantar | 49.15 | sept |
| 3.31 | rependida | |||
| THF- d 8 | 3.58 | cantar | 67.57 | rependida |
| 1.73 | cantar | 25.37 | cantar |
*Tenga en cuenta que el acoplamiento a 2 H produce patrones diferentes que el acoplamiento a 1 H.

