6.1: Introducción a la Espectrometría de Masas
- Page ID
- 79125
A través de la espectrometría de masas podemos aprender la masa molecular de un compuesto (más comúnmente llamado el peso molecular). Conocer el peso molecular nos ayuda a determinar una estructura limitando las posibilidades de la fórmula molecular.
Las moléculas individuales a menudo se desmoronan durante el experimento de espectrometría de masas. Como resultado, además de medir la masa de una molécula entera, también obtenemos los pesos de varias piezas más pequeñas de la molécula. Eso puede agregar cierta confusión a los datos. Sin embargo, estos fragmentos proporcionan una idea sobre qué partes componen la molécula completa.
Un espectro de masas de hexano (peso molecular 86) ilustra cómo se ven los datos.
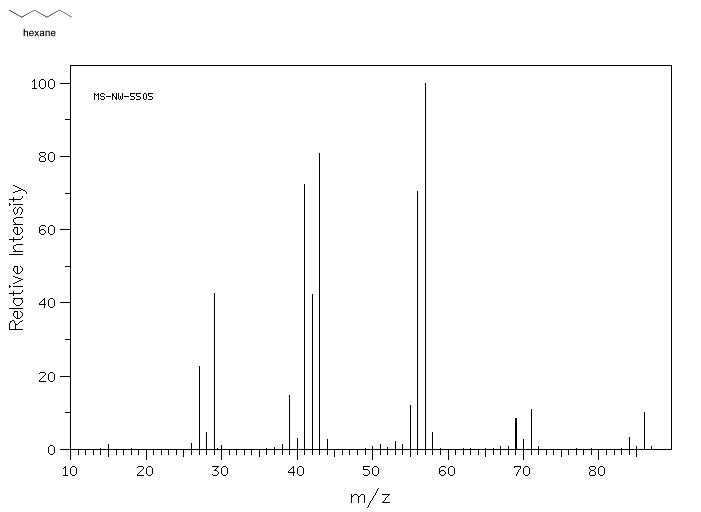
Fuente: SDBSWeb: http://riodb01.ibase.aist.go.jp/sdbs/ (Instituto Nacional de Ciencia y Tecnología Industrial Avanzada de Japón, 22 de agosto de 2008)
- El eje y suele ser etiquetado como “abundancia” o “intensidad relativa”. Este eje muestra cómo las relaciones relativas de moléculas en la muestra que tienen una masa particular.
- El eje x está etiquetado como “m/z” y corresponde a la masa molecular. La designación m/z se refiere al hecho de que esta técnica realmente mide la relación entre la masa de un ion y su carga.
- Un espectro de masas no muestra los resultados de una molécula, sino de millones de moléculas. Debido a que está mostrando resultados para una población de moléculas, se muestra más de una masa
- Muchas de las moléculas de la muestra se desmoronan durante el experimento.
- Un espectro de masas es un gráfico de barras que muestra los pesos de moléculas enteras, así como piezas más pequeñas de moléculas. Toda la molécula debe tener la masa más grande, la más alejada a la derecha, porque si una molécula cae en pedazos las piezas serían más pequeñas que la totalidad.
La siguiente figura muestra el espectro de masas de un hidrocarburo saturado (que contiene solo carbono e hidrógeno con solo enlaces simples entre carbonos, no dobles enlaces).
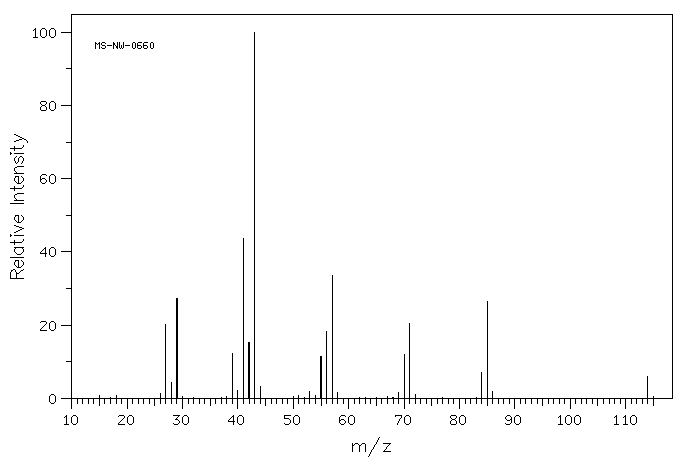
- Dibujar cinco estructuras diferentes que tendrían el peso molecular de este compuesto.
- Elija cuatro valores m/z más pequeños del espectro y dibuje una estructura para cada uno de ellos. Tenga en cuenta que estos fragmentos no tendrán estructuras completas de Lewis.

