6.2: El experimento de espectrometría de masas
- Page ID
- 79133
¿Cómo podemos “pesar” algo tan pequeño como una molécula? En espectrometría de masas, se puede utilizar el equilibrio entre dos fenómenos físicos diferentes para medir la masa.
- Uno de estos fenómenos es la inercia; un objeto en movimiento con más masa no puede ralentizar ni girar tan rápido como un objeto con menos masa.
- El segundo fenómeno es la interacción de una partícula cargada con un campo magnético.
Cuando se coloca en un campo magnético, una partícula cargada (como un electrón o protón) será atraída hacia un extremo del campo. Cuando se acopla con el fenómeno de la inercia, esta atracción magnética se puede utilizar para diferenciar entre partículas con diferente masa.
- Debido a que un ion que se mueve muy rápido tiene inercia, tiende a seguir moviéndose en línea recta.
- Si se coloca un campo magnético a través de la trayectoria del ion, el ion se desviará de su trayectoria debido a la atracción magnética.
Supongamos que dos partículas que se mueven paralelas entre sí entran en un campo magnético al mismo tiempo. Una de estas partículas es más pesada que la otra. Ambos se desvían un poco de su camino original, pero una de las partículas —la más pesada— no gira con tanta facilidad y por lo tanto no se desvía tanto. Si podemos medir hasta qué punto se desvía cada partícula, es posible que podamos tener una idea de la masa en cada caso.
- Cuanto más pesado sea el ion, menos se desviará de su trayectoria, porque su inercia lo sigue llevando hacia adelante.
- Cuanto más ligero sea el ion, más bruscamente se desviará de su camino, porque no tiene mucha inercia para mantenerlo recto.
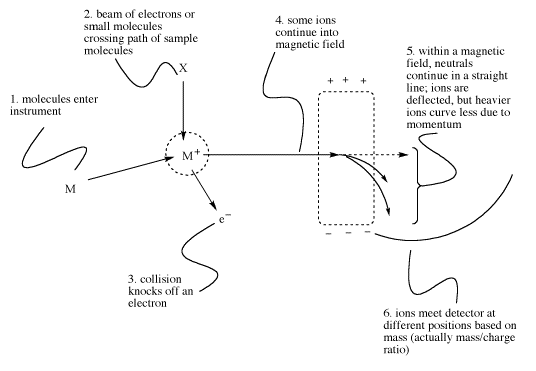
La espectrometría de masas solo funciona con iones, no con moléculas neutras. Eso significa que una molécula neutra debe cargarse para poder realizar este experimento. Es común generar un catión a partir de la molécula eliminando un electrón. El electrón es derribado de la molécula en una colisión. La colisión puede ser causada de dos maneras diferentes:
- La molécula puede ser enviada a través de una corriente de electrones de alta energía. Este método se llama ionización de electrones.
- La molécula se envía a través de una corriente de moléculas pequeñas, como amoníaco o metano. Este método se llama ionización química.
- La ionización de electrones frecuentemente da como resultado que la molécula caiga en pedazos debido a la alta energía de los electrones.
- La ionización química resulta en una colisión “más suave” porque el momento puede disiparse a través de varios enlaces en ambas moléculas colisionantes. La ionización química da como resultado una menor fragmentación de la molécula diana.
- Sin embargo, después de la ionización química, la molécula ionizante a veces se adhiere a la molécula diana, lo que lleva a una mayor masa “molecular”. Por ejemplo, si se usa amoníaco para la ionización, se puede observar una masa extra a 17 amu mayor de lo esperado.
Los datos de un espectro de masas muestran la abundancia de iones de diferentes masas en el espectrómetro. Debido a que las moléculas tienden a desmoronarse bajo estas condiciones, se observan muchas masas diferentes para una molécula. La mayoría de estas masas corresponden a trozos más pequeños de la molécula después de que se ha desmoronado. Sin embargo, debido a que siempre estamos trabajando con un gran número de moléculas cuando miramos una muestra, existe una probabilidad estadística de que al menos algunas de las moléculas permanezcan intactas durante el experimento. Además, debido a que estamos viendo una población de moléculas, obtenemos una gráfica que nos dice el probable destino de la molécula bajo estas condiciones. A lo mejor la molécula tiene una alta probabilidad de desmoronarse de cierta manera para producir un fragmento de cierta masa. En ese caso, vemos una gran abundancia de iones en el espectrómetro con esa masa. Los resultados se parecen a los datos simulados a continuación.
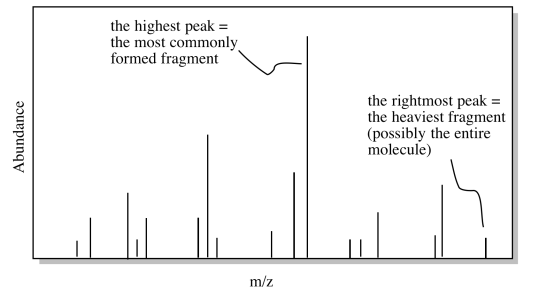
Por supuesto, si la molécula sí logra mantenerse unida, entonces será más grande que cualquiera de los fragmentos que resultarían si se desmoronara. La molécula intacta se mostrará al peso molecular más alto, a la derecha en la gráfica. Todos los picos a su izquierda representarían diferentes formas en las que la molécula se desmorona.
La razón por la que el eje x en un espectro de masas se etiqueta m/z (relación masa-carga) es para reconocer que realmente hay dos factores que contribuyen al experimento. La “masa” o peso molecular que se mide realmente es la relación entre el peso molecular del ion y su carga. En moléculas pequeñas, el instrumento suele medir iones con una carga de +1. En ese caso, el eje x muestra realmente la masa de la molécula o de un fragmento.
Sin embargo, las moléculas grandes como las proteínas tienen muchos, muchos sitios donde se pueden formar iones. Lo más obvio es que tienen muchos grupos amino que podrían captar protones adicionales. En ese caso, el cargo no es solo +1. Lo que a menudo se observa es un cúmulo de picos que representan diferentes cargas pero relacionados por el peso molecular de una proteína.

