6.5: Peso Molecular, Fórmula Molecular y Grados de Insaturación
- Page ID
- 79132
Encontrar el peso molecular de un compuesto en el espectro de masas puede proporcionar evidencia valiosa para una estructura. Esta información es especialmente valiosa si ya tenemos una idea de cuál podría ser la estructura. En ese caso, podríamos simplemente comparar el peso molecular observado con el que se esperaba.
Si no sabemos cuál es la estructura, conocer la fórmula molecular sí limita las posibilidades. Sólo habrá tantas combinaciones de átomos que sumen un cierto peso molecular. En combinación con otra información, como RMN e IR espectroscopía, podríamos elaborar una fórmula que se ajuste al peso molecular observado.
Existen espectrómetros de masas que están diseñados para medir el valor de m/z con tanta precisión que las posibles fórmulas moleculares disminuyen a solo un puñado. Estos espectrómetros de masas de “alta resolución” se basan en el hecho de que las masas atómicas de diferentes átomos no son números enteros exactos. La masa atómica de un átomo de 1 H (el isótopo que solo tiene un protón en el núcleo, y ningún neutrón) es en realidad 1.0078 amu, no 1.0000 amu. La masa atómica de un átomo de 10 B es en realidad cercana a 10.0129 amu, en lugar de los 10.0000 amu que podrías esperar. Estas son las masas de átomos individuales, no masas promedio que toman en cuenta diferentes isótopos. Un espectrómetro de masas de alta resolución medirá la masa de la molécula con tanta precisión que puede calcular las pocas combinaciones de átomos que podrían combinarse para producir esa masa.
Una vez que tenemos una fórmula, en realidad obtenemos una gran cantidad de información automáticamente. Una de las piezas más importantes es “unidades de insaturación” o “grados de insaturación” (DU). El DU es el resultado de una comparación formal de la relación C/H en el compuesto con la de un alcano normal. En un alcano normal, la fórmula es siempre C n H 2n+2. Si imaginas una cadena larga de hidrocarburos, habrá dos hidrógenos en cada carbono a lo largo de la cadena, más uno más hidrógeno en cada extremo de la cadena. Sin embargo, un alqueno contiene un enlace pi, y en el sitio de ese enlace pi hay dos átomos de hidrógeno que faltan en esa fórmula alcano. Un alqueno simple siempre tiene la fórmula C n H 2n. Ese par faltante de hidrógenos en la fórmula se llama grado de desesturación.
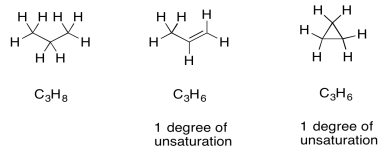
Lo mismo le pasa también a la fórmula si hay un anillo presente. Una DU puede corresponder a la presencia de un doble enlace o un anillo. Si DU=2, puede haber dos dobles enlaces, dos anillos, o uno de cada uno.
Si hay átomos de oxígeno presentes en la fórmula, podemos simplemente ignorarlos y prestar atención a la parte hidrocarbonada. Conceptualmente, debido a que el oxígeno forma dos enlaces, podemos pensar que se aprieta entre dos átomos cualesquiera en una estructura hidrocarbonada para formar un nuevo compuesto. La relación de carbono a hidrógeno no cambia. Si hay un grado de desesturación en una fórmula que contiene oxígeno, simplemente sugiere la presencia de un anillo o un doble enlace, al igual que en un hidrocarburo.
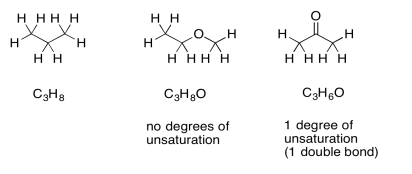
Supongamos que la fórmula es C 9 H 10 O 2. Podemos ignorar los oxígenos y mirar el C 9 H 10. Si éste fuera un hidrocarburo saturado con nueve carbonos, su fórmula sería C 9 H 20 (ya que 2 x 9 + 2 = 20). Nos faltan cinco pares de hidrógenos, por lo que DU = 5. Eso es mucho. Sin embargo, si tenemos un benceno en la estructura, eso representaría tres dobles enlaces y un anillo todos a la vez. Eso es cuatro grados de insaturación. Un carbonilo adicional u otro doble llevaría el número hasta los cinco requeridos. Si aún no hubiéramos llegado a la idea de un anillo de benceno, esta comparación podría hacernos pensar en ello.
En ocasiones, si hay otros átomos presentes, necesitamos ajustar la fórmula para tomarlos en cuenta. Por ejemplo, cada vez que se encuentra un halógeno en la estructura, reemplaza conceptualmente a un átomo de hidrógeno. Para que se encuentre un halógeno en la estructura, tendría que haber uno menos átomos de hidrógeno para abrir una mancha para el halógeno. Para ajustarnos a la presencia de un halógeno, necesitamos agregar un hidrógeno a la fórmula, luego compararlo con la fórmula de alcano estándar.
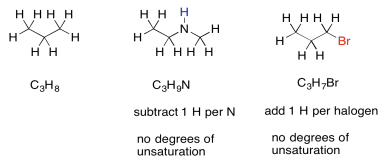
El nitrógeno, por otro lado, tiene tres enlaces. A diferencia del oxígeno, si lo apretamos entre otros dos átomos, todavía necesita un enlace extra. Siempre aporta un hidrógeno extra a la fórmula. Para ajustar la presencia de nitrógeno, necesitamos restar un H de la fórmula, luego compararlo con la fórmula alcano estándar.

