6.4: Iones moleculares
- Page ID
- 79137
El ion que resulta de la pérdida de un electrón se denomina ion molecular. El ion molecular es un ejemplo de catión radical. Es un catión por su carga positiva, y un radical porque no todos sus electrones se encuentran en pares.
Debido a que un electrón es tan ligero comparado con la masa de todos los protones y neutrones en la molécula, la masa del ion molecular es esencialmente la misma que la de la molécula original.
El ion molecular, por supuesto, tiene la misma estructura que la molécula original, menos un electrón. Pero, ¿de dónde viene el electrón perdido? Por lo general, se observa la siguiente tendencia:
- Los electrones se pierden más fácilmente de pares no enlazados, ya que los electrones de unión están a menor energía y son más estables (ese es el punto de formar un enlace) y por lo tanto serían más difíciles de eliminar.
- Si no hay pares no enlazados, los electrones se pierden más fácilmente de los enlaces pi, porque los enlaces pi generalmente tienen una energía más alta que los enlaces sigma.
- Si no hay pares no enlazados ni enlaces pi, los electrones se pierden más fácilmente de los enlaces sigma.
Así, en 2-pentanona el electrón se perdería más fácilmente de un par solitario; en hexeno se perdería más fácilmente del enlace pi, y en heptano se perdería más fácilmente de un enlace sigma.
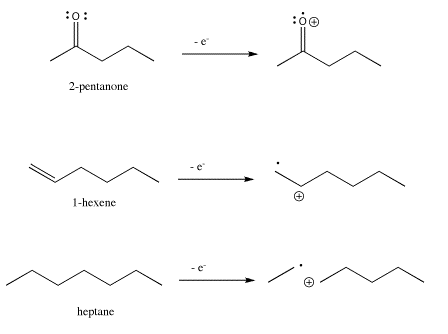
Figura\(\PageIndex{1}\): Ionización en tres compuestos orgánicos diferentes.
Dibuje una ecuación para la formación de un ion molecular a partir de cada uno de los siguientes compuestos.