6.11: Vías de fragmentación
- Page ID
- 79140
Cuando las moléculas pasan por un espectrómetro de masas, se rompen en pedazos de diversas maneras. Hay muchas formas en las que las moléculas podrían romperse, pero algunas de estas vías son especialmente útiles de conocer.
Fragmentación alfa
Una fragmentación alfa es impulsada tanto por la formación de enlaces como por la estabilidad catiónica. Tras la pérdida de un electrón, que es más comúnmente un electrón no enlazante o un par solitario, un solo electrón se deja atrás en un heteroátomo. Ese solo electrón se llama radical. Al robar un electrón de un enlace vecino, ese radical puede emparejarse. Se forma un nuevo vínculo.
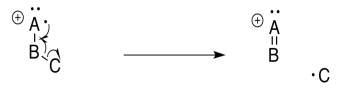
Por ejemplo, supongamos que el átomo de oxígeno en una cetona pierde un electrón. Eso deja al átomo de oxígeno sin octeto. El átomo tiene siete electrones en su caparazón de valencia en lugar de ocho. Si el átomo de carbono vecino tuviera un solo electrón para compartir, entonces los dos átomos podrían aportar cada uno un electrón para formar un nuevo enlace. Ambos átomos tendrían octetos.
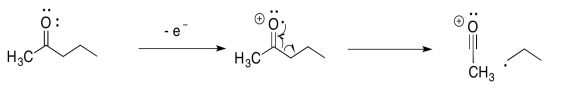
En la fragmentación alfa, un enlace que viene del carbono alfa al oxígeno se rompe por la mitad. Un electrón permanece atrás, pero el otro electrón se empareja con el radical para hacer un nuevo enlace.
Recuerde, un término común para un átomo vecino es la posición alfa. En un carbonilo, la posición alfa es solo el carbono al lado del carbonilo. En espectrometría de masas, la posición alfa es el átomo próximo al átomo que tiene el electrón simple o radical. En una fragmentación alfa, algo rompe ese átomo vecino, liberando un electrón para hacer un nuevo enlace. Cuando lo hace, produce un nuevo radical o electrón desapareado; esto es un ejemplo de un “paso de propagación” en una “reacción radical en cadena”.
La fragmentación alfa mostrada anteriormente para 2-pentanona es solo una de las dos reacciones de este tipo. Muéstrale el otro.
- Contestar
-
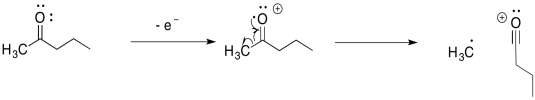
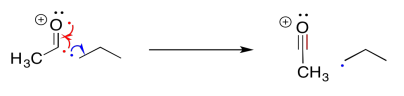
Otros compuestos experimentan fragmentaciones similares. Las fragmentaciones alfa son muy comunes en compuestos que contienen oxígeno y nitrógeno como alcoholes y aminas. Aquí está la vía en 2-pentanol:
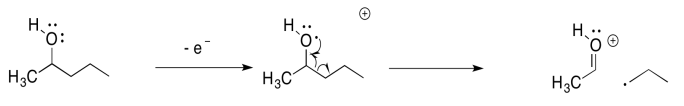
La fragmentación alfa mostrada anteriormente para el 2-pentanol es solo una de las tres reacciones de este tipo para ese catión radical. Muéstrale los otros dos.
- Contestar
-
Ahora, la característica clave de la espectrometría de masas es que puede detectar la masa de cationes. Eso significa que si una molécula se escinde en dos pedazos, solo la parte con la carga positiva es detectada por el espectrómetro de masas. La otra parte es invisible. En el ejemplo con 2-pentanona, anterior, el catión acilo, CH 3 CO +, se detectaría a m/z = 43 amu.
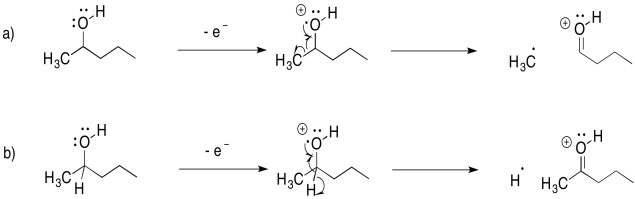
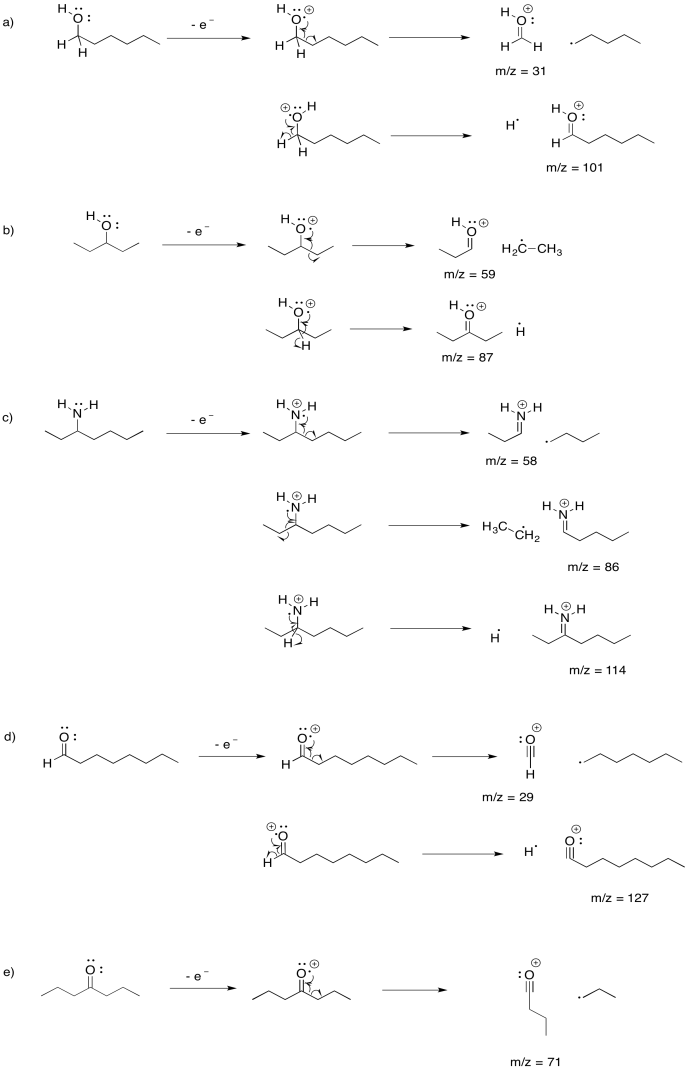
Dibujar las posibles fragmentaciones alfa que resultarían después de la pérdida de un electrón no enlazante de cada una de las siguientes moléculas, e indicar el valor m/z de los fragmentos que serían detectados:
a) 1-hexanol b) 3-pentanol c) 3-aminoheptano d) octanal e) 4-heptanona
- Contestar
-
Reordenamiento de McLafferty
Otra vía común se llama reordenamiento de McLafferty. Ocurre en cadenas un poco más largas. Eso es porque depende de que una cadena se envuelva hasta que forme un lazo; entonces, un extremo de la cadena puede reaccionar con otro. El resultado final es la pérdida de un alqueno del catión radical original; sin embargo, a diferencia de la fragmentación alfa, tanto el catión como el radical permanecen en la misma molécula después del reordenamiento de Mclafferty.
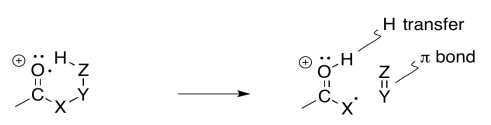
Si sabes algo sobre el análisis conformacional o sobre los estados de transición, puede que no sea sorprendente escuchar que una interacción de seis átomos es una característica clave de este evento. En el siguiente ejemplo, que involucra a 2-decanona, si se piensa en el oxígeno como átomo número 1, podemos ver un hidrógeno que se abstrae del átomo 5; el hidrógeno es el sexto átomo en una fila, extendiéndose desde el oxígeno.
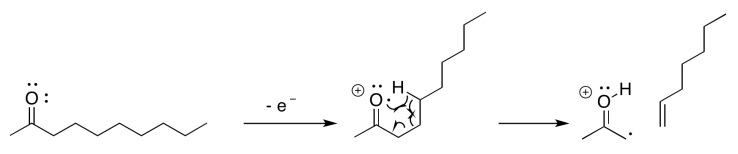
A veces es útil descomponer las cosas complicadas en partes más simples. Eso nos permite centrarnos en un aspecto de la reacción a la vez. En este caso, existe una abstracción de átomos de hidrógeno que ocurre entre el sitio del radical inicialmente formado y un átomo de hidrógeno que es el sexto átomo a lo largo. Al mismo tiempo, a medida que ese nuevo radical se forma, comienza a sacar un electrón de un enlace vecino para que pueda emparejarse. Ese aspecto es como una fragmentación alfa.
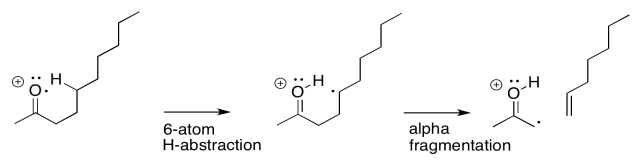
La reacción real ocurre de una vez, sin embargo, en lugar de un paso a la vez. A medida que se abstrae el átomo de hidrógeno, el electrón restante se empareja con un compañero que proviene de un enlace vecino. Ese vínculo vecino es parte del estado de transición del anillo de seis miembros.
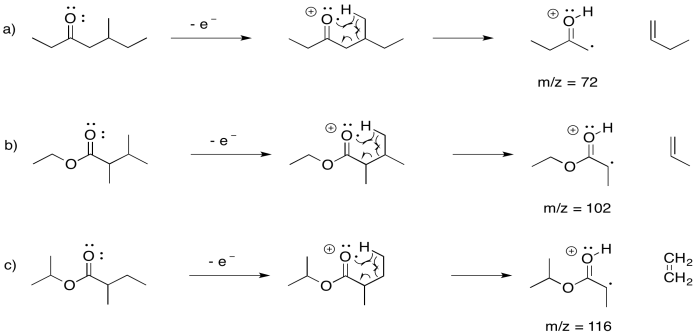
Proporcionar mecanismos para los reordenamientos de McLaFerty para cada uno de los siguientes ésteres. También, incluir los valores m/z de los picos correspondientes en el espectro de masas.
- 5-metilheptan-3-ona
- 2,3-dimetilbutanoato de etilo
- 2-metilbutanoato de isopropilo
- Contestar
-
Escisión inductiva
La escisión inductiva puede ser el mecanismo más simple de todos. Si se pierde un electrón de un átomo electronegativo, la forma más sencilla de gestionar la estabilidad catiónica es transferir completamente la carga positiva a un átomo menos electronegativo.
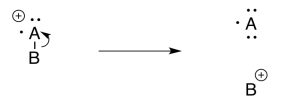
Si, por ejemplo, y el oxígeno o un nitrógeno se une a un carbono, entonces una vez que se forma la carga positiva en el oxígeno, puede sacar un par de electrones del carbono.
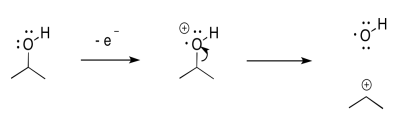
En esa, la escisión del enlace heterolítico, el oxígeno se ha librado de la carga positiva. Ahora es el problema del carbono. El carbono es menos electronegativo que el oxígeno, por lo que la reacción se ve favorecida en esta dirección.
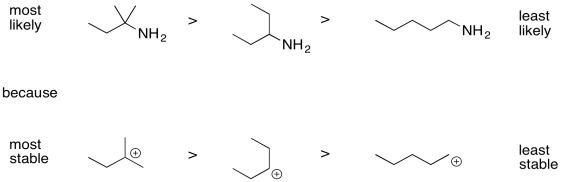
Ordene los siguientes compuestos desde los más probables de sufrir escisión inductiva hasta los menos propensos a sufrir escisión inductiva.
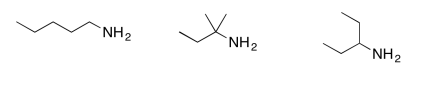
- Contestar
-
Hay una variación añadida de esta vía que ocurre específicamente con los alcoholes. El radical OH que sale puede abstraer un átomo de hidrógeno de la siguiente posición en la molécula. Esta etapa es impulsada por la formación de un enlace OH, que es relativamente fuerte. En general, el resultado es la pérdida de una molécula de agua del ión molecular.
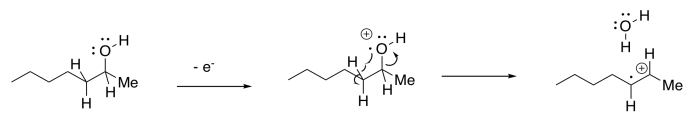
Escivaje Sigma
¿Y si no hay lugares obvios para que ocurra la ionización inicial? Un hidrocarburo saturado, por ejemplo, no tiene pares solitarios. Ni siquiera tiene ningún enlace pi. No hay posiciones claras donde se formaría un catión.
Sin embargo, bajo condiciones ionizantes, un electrón puede ser liberado de un hidrocarburo, y tiene que provenir de un orbital de enlace sigma; no hay ningún otro lugar. Cuando eso sucede, el enlace sigma ya se ha roto, o al menos muy debilitado, en un solo paso. Hemos pasado de un enlace de dos electrones a un enlace de un electrón; la energía de estabilización es solo la mitad de lo que comenzó como, y así el enlace se rompe fácilmente.
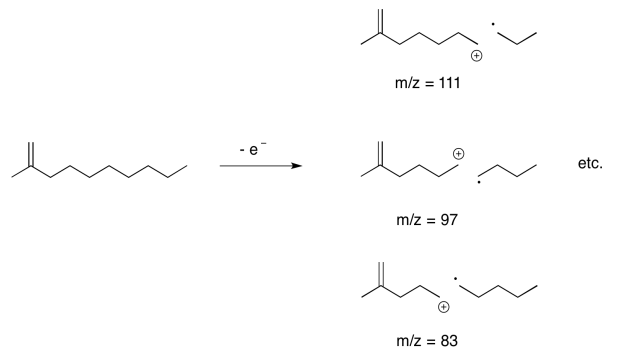
Es muy común en los espectros de masas de cadenas de hidrocarburos ver una serie de picos separados por 14 unidades. Esa diferencia corresponde a una unidad CH 2 en la cadena hidrocarbonada.
Predecir los picos que se observarían derivados de la escisión sigma en los siguientes compuestos.
- hexano
- butilbenceno
- Contestar
- Contestar a
-
m/z = 71, 57, 43, 29
- Respuesta b
-
m/z = 119, 105, 91, 77

