7.3: Destilación
- Page ID
- 79168
La destilación es un método de purificación de compuestos orgánicos. Se aprovecha que dos compuestos diferentes probablemente tengan dos puntos de ebullición diferentes. Supongamos que dos líquidos diferentes están presentes en una mezcla homogénea (son completamente miscibles, o se mezclan completamente, como el agua y el alcohol). Si tienen dos puntos de ebullición diferentes, uno de los compuestos se evaporará antes que el otro. El compuesto más volátil (el que se evapora fácilmente) dejará atrás el compuesto menos volátil.
La destilación es probablemente una palabra familiar. Las destilerías son fábricas que producen bebidas alcohólicas, como el whisky, a partir de la fermentación de granos, como el maíz o el centeno. En el corazón de la destilería se encuentra un gran aparato de destilación. Este “todavía” se utiliza para purificar la mezcla de alcohol/agua por evaporación, dejando atrás la mayoría de los demás componentes del grano. Ese proceso es un poco más complicado que el aquí descrito, pero es similar.
En la destilación, se pone una mezcla en un recipiente y el recipiente se coloca sobre una fuente de calor. Un tubo se aleja del contenedor. En ocasiones este tubo se enfría con agua fría, corriente o hielo; a veces simplemente se deja enfriar en el aire. También hay un segundo recipiente para recoger el líquido que destila.
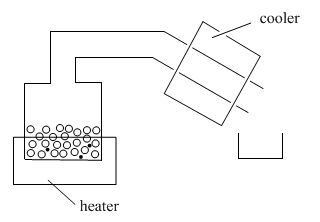
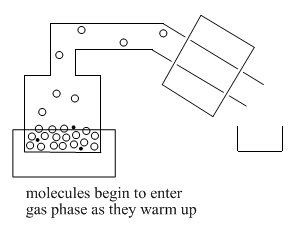
A medida que se calienta el recipiente o “olla”, el líquido volátil comienza a evaporarse. Las moléculas entran en la fase gaseosa y comienzan a flotar a través del tubo que se aleja de la olla. En el laboratorio, el tubo por encima de la olla se llama la “cabeza fija”.
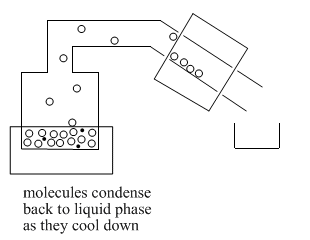
Una vez que las moléculas pasan por la cabeza inmóvil, llegan al “condensador”. A menudo el condensador es enfriado por agua fría que fluye a lo largo de fuera de él. Cuando las moléculas alcanzan el condensador frío, ceden algo de energía térmica y se condensan de nuevo a la fase líquida.
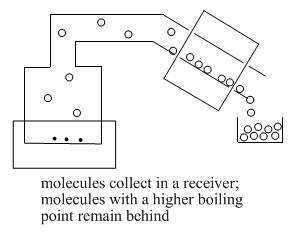
A medida que suficientes moléculas se condensan en la fase líquida, comienzan a formar gotas de líquido. Este líquido se recoge en un “matraz receptor”.
Decidir si las siguientes mezclas son buenas candidatas para la destilación.
- Se tiene una muestra de pentano (mp: -129°C; bp: 36°C) contaminado con 1-octanol (mp: -16°C; bp: 195°C).
- Se tiene una muestra de 1-hexanol (mp: -50°C; bp: 145°C) contaminado con 2-hexanol (mp: -16°C; bp: 140°C).
- Se tiene una muestra de benceno (mp: 5°C; bp: 80°C) contaminado con ácido benzoico (mp: 122°C; bp: 250°C).
- Se tiene una muestra de 2-butanona (mp: -86°C; bp: 80°C) contaminada con tolueno (mp: -95°C; bp: 111°C).
- Se tiene una muestra de naftaleno (mp: 78°C; bp: 218°C) contaminado con 2-naftol (mp: 120°C; bp: 285°C).
- Se tiene una muestra de 1-hexanol (mp: -50°C; bp: 145°C) contaminado con 1-hexeno (mp: -140°C; bp: 63°C).
- Responder
- Contestar a
-
Sí, estos compuestos son ambos líquidos y la diferencia de punto de ebullición es grande.
- Respuesta b
-
No, estos compuestos son ambos líquidos pero la diferencia del punto de ebullición es pequeña.
- Respuesta c
-
Sí, el compuesto que quieres purificar es un líquido y la diferencia de punto de ebullición es grande. No obstante, habría que tener mucho cuidado de no char el material restante en el matraz.
- Respuesta d
-
Sí, estos compuestos son ambos líquidos y la diferencia de punto de ebullición es grande.
- Respuesta e
-
No, estos compuestos son ambos sólidos. La destilación no es una buena idea.
- Respuesta f
-
Sí, estos compuestos son ambos líquidos y la diferencia de punto de ebullición es grande. No obstante, habría que tener cuidado de no char el material deseado; a medida que destila (después de que se elimine el contaminante), su volumen se hará más pequeño. En algún momento, la disipación de calor se convertirá en un problema para el material restante.

