7.4: Sublimación
- Page ID
- 79203
La sublimación es conceptualmente similar a la destilación. Es un método en el que se calienta una muestra impura y una muestra más pura recoge en algún lugar más fresco cercano. En lugar de depender de un equilibrio entre la fase líquida y la fase gaseosa, la sublimación implica un equilibrio entre la fase sólida y la fase gaseosa.
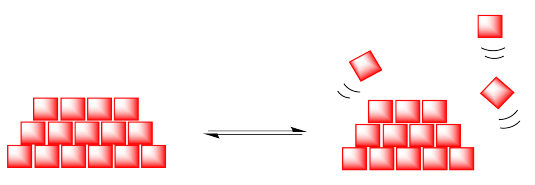
A temperaturas más bajas, se espera que un material sólido sea cristalino y ordenado. Sin embargo, a temperaturas más altas, las moléculas en el sólido pueden ganar suficiente energía para que puedan escapar a la fase gaseosa.
Tu experiencia normal te dice que es que calientas un sólido, simplemente se funde en líquido. Para obtener un gas, necesitas calentar ese líquido. Sin embargo, si alguna vez has pasado tiempo en un lugar frío y nevado en un día soleado, tal vez te des cuenta de que esa idea no siempre es cierta. En días soleados y fríos, un banco de nieve se encogerá y encogerá sin dejar charcos. ¿A dónde van todas las moléculas de agua? En la fase gaseosa. Flotan lejos en el aire.
- En la sublimación, las moléculas en la fase sólida escapan directamente a la fase gaseosa.
Sin embargo, en un método de purificación, normalmente queremos obtener un material de nuevo en su forma original, solo que sin las impurezas. Queremos que esas moléculas en fase gaseosa vuelvan a formar un sólido.
Por supuesto, en los días de invierno, eso pasa todo el tiempo. El vapor de agua en el aire forma rutinariamente de nuevo hielo cristalino, que luego cae como nieve. El truco es dejar que las moléculas de la fase gaseosa suban a un lugar lo suficientemente frío como para despojar un poco de energía y desplazar ese equilibrio de nuevo hacia el sólido.
En el laboratorio, podemos construir un aparato de sublimación simple de varias maneras diferentes, pero siempre hay dos componentes clave. Necesitamos un vaso exterior o vaso inferior. Este es el lugar donde pondríamos la muestra impura. También necesitamos un vaso interno o vaso superior. Este es el lugar donde queremos que se vuelva a formar el sólido puro.
- Para purificar por sublimación, las moléculas en la fase sólida se calientan para que pasen a la fase gaseosa, luego se enfrían para formar nuevamente un sólido.
Por lo general, el enfriamiento es proporcionado por hielo viejo o agua fría. Ocasionalmente, se puede usar hielo seco. El calor no suele ser proporcionado por una llama abierta, sino por una placa caliente o baño de calentamiento.
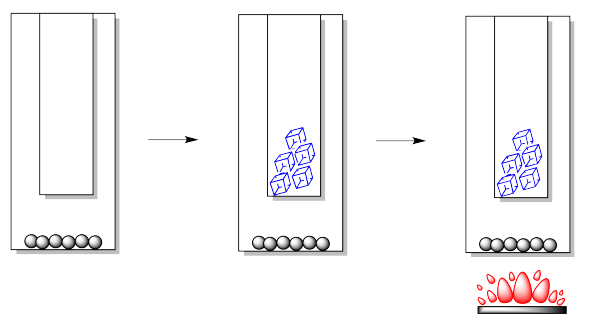
Después de calentar la muestra por algún tiempo, los cristales comienzan a formarse más altos en el aparato. Por lo general, se forman en el dedo frío, pero también pueden formarse más arriba en las paredes del vaso exterior. Los cristales pueden aparecer primero en diferentes formas o hábitos: pueden ser ligeros y plumosos, redondos y escamosos, agujas o bloques.
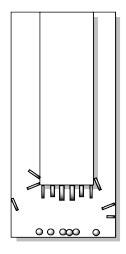
Con mucho cuidado, el dedo frío debe estar separado del vaso exterior. A veces los cristales apenas se cuelgan de su percha, por lo que el más mínimo movimiento hará que caigan. Otras veces, pueden estar muy firmemente adheridas y podría tomar un poco de esfuerzo rasparlos.

