7.13: Cromatografía de Afinidad
- Page ID
- 79177
La Cromatografía de Afinidad utiliza una fase estacionaria que está diseñada para unirse a una molécula específica con el fin de aislar esa molécula de una mezcla. Por ejemplo, este método se utiliza frecuentemente para purificar proteínas. La proteína que nos interesa tiene que tener propiedades bien definidas para que sepamos qué poner en la fase estacionaria que unirá a la proteína. Las proteínas que se unen al empaque pasan más tiempo en la fase estacionaria. Las proteínas que no se unen al empaque pasan menos tiempo en la fase estacionaria y así se mueven a través de la columna más rápidamente.
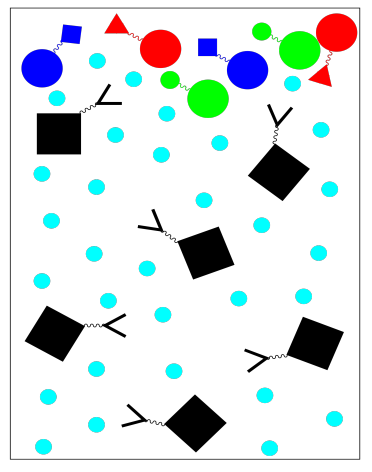
Por ejemplo, si deseamos purificar una proteína específica, podríamos usar una fase estacionaria en la que una resina sólida se une a cadenas peptídicas específicas. Estas cadenas peptídicas serían elegidas porque sabemos que se unen bien a la proteína específica de interés; son buenos ligandos para esta proteína. Cuando se carga una mezcla de proteínas en la columna y se lava con un tampón, solo la proteína de interés se atascará en la fase estacionaria. Todo lo demás debería seguir moviéndose en la fase móvil.
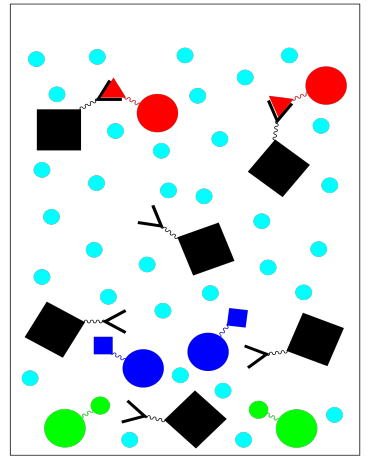
A diferencia de otros tipos de cromotografía, la cromatografía de afinidad es binaria. Sólo hay dos fracciones: la que queremos y la que no queremos. El que no queremos sale ya que lavamos la columna con buffer.
Para obtener la fracción que sí queremos, necesitamos eluir la columna con una solución de elución. La solución eluida cambia las condiciones para que la proteína que queremos ya no se pegue a la fase estacionaria. Por ejemplo, un cambio en la solución tampón puede dar como resultado algunos cambios conformacionales que hacen que la proteína se una menos estrechamente a su ligando. Recopilamos esta fracción de proteína purificada.
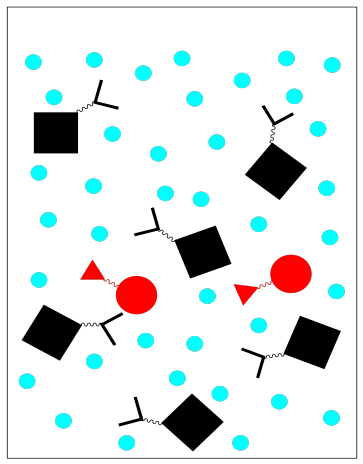
Existen otras variaciones en la cromatografía de afinidad. Por ejemplo, los anticuerpos pueden purificarse de esta manera uniendo antígenos complementarios a la fase estacionaria. También se podría usar una secuencia peptídica o nucleotídica porque se une a ADN o ARN.

