7.14: Electroforesis
- Page ID
- 79202
La electroforesis es un método para separar moléculas cargadas entre sí. Para ello, se aplica un voltaje a través de la muestra. Las moléculas de carga positiva son atraídas hacia el electrodo negativo y las moléculas cargadas negativamente son atraídas hacia el electrodo positivo.
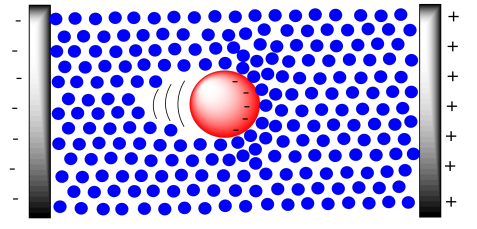
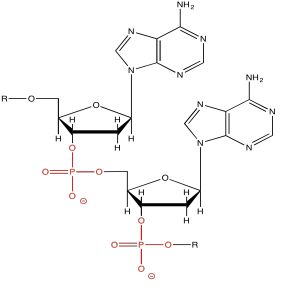
Normalmente, este método se aplica para la purificación o análisis de moléculas muy grandes, como proteínas y ADN. Estas moléculas están cargadas para empezar, por lo que son buenas candidatas para el movimiento vía campo eléctrico. El ADN está cargado negativamente debido a los grupos fosfato a lo largo de la cadena principal. Por supuesto el ADN va acompañado de contraiones, pero en una solución tampón la propia molécula de ADN actuará como un anión grande, y se moverá hacia el electrodo positivo.
Las proteínas también están cargadas porque contienen grupos finales cargados y cadenas laterales. Se elige un tampón para dar la carga negativa neta de la proteína, con más sitios aniónicos que los catiónicos. De esa manera, también se moverá hacia el electrodo positivo.
Un aspecto práctico de la electroforesis es que las moléculas deben moverse a través de un medio de gel estacionario. Un gel está compuesto por una matriz sólida hinchada con líquido. Por ejemplo, el medio puede estar basado en agar o, en un método común, un gel de poliacrilamida (utilizado en electroforesis en gel PAGE), y se hincha con una solución tampón. El medio no está diseñado para unirse a las moléculas, pero sí ejerce arrastre sobre las macromoléculas a medida que se mueven a través de él. Eso es cierto de una molécula grande que se mueve por cualquier entorno; piensa en todas las moléculas de agua que tendrán que ser empujadas fuera del camino para dejar espacio a una enorme proteína a medida que migra a través. Ese arrastre ralentizará el avance de la muestra a través del campo eléctrico.
El resultado general es que el campo eléctrico mantiene todos estos aniones moviéndose en la misma dirección, pero el arrastre desde el medio ejerce un efecto de desaceleración. El arrastre es realmente la parte clave de la separación. Cuanto más grande es la molécula, mayor es el arrastre, y más lentamente se mueve la molécula. En la electroforesis en gel, las moléculas pequeñas se mueven más rápido y las moléculas grandes se mueven más lentamente.
Establecer electroforesis es básicamente similar a la cromatografía, aunque un poco más complicado. La idea sigue siendo como una carrera entre las moléculas. Empezamos con todas las moléculas en la misma línea de salida y vemos quién es el más rápido. Después de que un gel se ejecuta mediante electroforesis, el gel generalmente se tiñe con un tinte (como el azul de bromotimol) para que podamos ver hasta dónde se ha movido cada proteína.
Por lo general, se calibra un gel para que te hagas una idea de cuán grandes son las proteínas en tu mezcla. Una mezcla con componentes conocidos de pesos moleculares conocidos se ejecuta junto con la muestra que está analizando. Al comparar hasta dónde se movieron las proteínas de nuestra mezcla en comparación con las proteínas en la mezcla estándar, podemos estimar los pesos moleculares de las proteínas en nuestra propia mezcla.

Figura\(\PageIndex{4}\): Una caricatura que muestra un gel desarrollado.
Puede haber diferentes pasos en la electroforesis que están diseñados para hacer que las cosas vayan más suavemente. Por ejemplo, una mezcla de proteínas se complica por el hecho de que las proteínas tienen diferentes estructuras secundarias y terciarias; tienen diferentes formas. Una proteína compacta y esférica podría moverse de manera más eficiente a través de un gel que una proteína más abierta y floja. Como resultado, una proteína más pesada puede moverse más lejos en el gel que una más ligera simplemente por su forma. Para sortear este problema, se puede agregar un surfactante (una especie de jabón) a la mezcla; el surfactante con ayuda para desenrollar las proteínas para que todas estén en cadenas abiertas. Las proteínas están desnaturalizadas ahora, pero todas son más similares entre sí, y es más fácil compararlas basándose únicamente en el peso molecular o la longitud de la cadena.

