7.16: Soluciones para problemas seleccionados
- Page ID
- 79176
Ejercicio 7.1.1:
a) El más rápido: diclorometano > hexano > agua: más lenta
a) Más rápido: acetona > tolueno > dimetilsulfóxido: más lento
a) El más rápido: pentano > acetato de etilo > benceno: más lento
Ejercicio 7.2.1
a) Filtro: carbonato de sodio; filtrado: heptanal
a) Filtro: benzofenona; filtrado: cloruro de litio
a) Filtro: antraceno; filtrado: benzoato potásico
a) Filtro: cloruro de tris (etilendiamino) cobalto (III); filtrado: etilendiamina
Ejercicio 7.3.1:
- Sí, estos compuestos son ambos líquidos y la diferencia de punto de ebullición es grande.
- No, estos compuestos son ambos líquidos pero la diferencia del punto de ebullición es pequeña.
- Sí, el compuesto que quieres purificar es un líquido y la diferencia de punto de ebullición es grande. No obstante, habría que tener mucho cuidado de no char el material restante en el matraz.
- Sí, estos compuestos son ambos líquidos y la diferencia de punto de ebullición es grande.
- No, estos compuestos son ambos sólidos. La destilación no es una buena idea.
- Sí, estos compuestos son ambos líquidos y la diferencia de punto de ebullición es grande. No obstante, habría que tener cuidado de no char el material deseado; a medida que destila (después de que se elimine el contaminante), su volumen se hará más pequeño. En algún momento, la disipación de calor se convertirá en un problema para el material restante.
Ejercicio 7.5.1:
Es posible que una mezcla de hidróxido de sodio y oleato de sodio se pueda purificar mediante la adición de agua. Si se agregara la cantidad correcta de agua y la lechada resultante se agitara y filtrara, gran parte del hidróxido de sodio se eliminaría porque es más soluble en agua que el oleato de sodio. El oleato de sodio es menos soluble en agua que el hidróxido de sodio, por lo que la mayor parte no se disolvería. Podría ser recolectada o “aislada” por filtración.
Ejercicio 7.5.2:
El oleato de sodio tiene una cadena hidrocarbonada larga y no polar. Las cadenas de hidrocarburos no son muy solubles en agua. Eso es porque se meten entre las moléculas de agua y evitan que las moléculas de agua se unan entre sí.
Ejercicio 7.5.3:
La solución contiene agua, mucho hidróxido de sodio y un poco de oleato de sodio.
Ejercicio 7.5.4:
No. Si se evaporara el agua, el hidróxido de sodio seguiría atascado en el oleato de sodio.
Ejercicio 7.5.6:
Puede que tengas que filtrar esta impureza mientras todo lo demás aún está disuelto. Tal vez tengas que asegurarte de que todo se mantenga caliente mientras haces esto. Si las cosas se enfrían demasiado, la solubilidad disminuirá y los compuestos podrían solidificarse antes de que tú también los quieras. En ocasiones, al filtrar una solución acuosa, ayuda a poner un poco de agua caliente en el matraz filtrante y mantener todo caliente usando vapor.
Ejercicio 7.5.7:
El borneol parece demasiado soluble en el metanol. Si ya no tienes borneol, tendrás que evaporar de nuevo el metanol. Esta vez, agrega menos metanol; tal vez solo necesites un cuarto de mL o diez gotas o algo así. Para que una recristalización funcione, desea ver solubilidad parcial; desea que el compuesto se disuelva cuando está caliente pero no cuando está frío.
Ejercicio 7.5.8:
Esta es una buena señal. Intenta calentar el metanol para ver si se disuelve más. Si se disuelve cuando está caliente, intenta enfriarlo y ver si el sólido vuelve a aparecer.
Ejercicio 7.5.9:
Esto sigue siendo una buena señal, pero es posible que necesites agregar más metanol para que todo se disuelva. No olvides agitarlo o removerlo, también; eso ayudará a que se disuelva.
Ejercicio 7.6.1:
Tanto el agua como el éter (un apodo común para el éter dietílico) contienen átomos de oxígeno electronegativos. Debido a que ambos oxígenos están unidos a átomos de hidrógeno o carbono menos electronegativos, cada molécula tendrá un dipolo. Podemos esperar interacciones dipolo-dipolo y miscibilidad.
Ambos átomos de oxígeno tienen pares solitarios. Cualquiera de los dos podría actuar como aceptor de enlaces de hidrógeno. Debido a que el éter también contiene un enlace O-H muy polar (recuerde, los enlaces de hidrógeno involucran F, O, N), podemos esperar interacciones de enlaces de hidrógeno y miscibilidad.
Sin embargo, un enlace C-O en éter es menos polar que un enlace H-O en agua. Para que los dos líquidos sean miscibles, las interacciones dipolo-dipolo más fuertes entre las moléculas de agua tendrían que ser abandonadas y comercializadas por interacciones dipolo-dipolo más débiles entre las moléculas de agua y éter. Es posible que los dos líquidos no se mezclen.
El éter tiene un átomo de oxígeno con un par solitario, pero no tiene un enlace O-H muy polar. La posibilidad de enlaces de hidrógeno entre el agua y el éter es menor que entre las moléculas de agua solas. Es posible que los dos líquidos no se mezclen.
El éter tiene dos cadenas hidrocarbonadas hidrofóbicas, aunque son bastante cortas. Al mezclarse, estas cadenas deben acomodarse entre moléculas de agua vecinas, que de esta manera se evita que se unan hidrógeno entre sí. Es posible que los dos líquidos no se mezclen.
Ejercicio 7.6.2:
El éter más ligero estaría en la parte superior. El agua más pesada se hundiría hasta el fondo.
Ejercicio 7.6.3:
- Dadas dos capas separadas, el metanol más ligero estaría en la parte superior. El agua más pesada se hundiría hasta el fondo.
- El metanol y el agua son miscibles. Ambos son completamente capaces de formar enlaces de hidrógeno; cada uno de ellos es donador y aceptor de enlaces de hidrógeno. Aunque el metanol tiene un componente hidrocarbonado no polar, los grupos metilo no son lo suficientemente grandes como para interrumpir significativamente los enlaces de hidrógeno entre las moléculas de agua vecinas.
Ejercicio 7.6.4:
- Tal vez los compuestos son sales, que contienen un anión y un catión. Los aniones y cationes podrían ser simples inorgánicos como Li + y F -, pero el anión o el catión también podrían ser orgánicos (conteniendo porciones de hidrocarburos). Si los compuestos son orgánicos y no iónicos, o bien las moléculas serían completamente capaces de formar enlaces de hidrógeno (que contienen enlaces O-H o N-H), o bien contendrían enlaces altamente polares como C=O. Además, los compuestos no deberían contener una proporción demasiado grande de hidrocarburo en comparación con la parte polar; para neutros compuestos, eso significa una relación carbono:oxígeno inferior a aproximadamente 4:1, aunque la relación puede ser significativamente mayor para los compuestos iónicos.
- Los compuestos deben ser neutros, no iónicos. Si bien pueden contener enlaces polares, el compuesto debe ser mayoritariamente no polar; una regla aproximada es que la relación carbono:oxígeno debe ser mayor a 4:1.
Ejercicio 7.6.5:
a) parte inferior b) parte superior c) parte superior d) parte superior e) parte inferior f) parte superior g) parte inferior h) parte superior
Ejercicio 7.6.6:
Los compuestos iónicos pueden formar fuertes interacciones ión-dipolo con las moléculas de agua. Esa interacción mejora su solubilidad en agua.
Ejercicio 7.6.7:
Se debe agregar agua y éter a la mezcla y la mezcla debe agitarse hasta que se disuelva. Las capas deben estar separadas. El agua debe extraerse con éter adicional y las capas etéreas combinadas deben lavarse con salmuera. Las capas de éter deben secarse con sulfato de sodio, filtrarse y evaporarse al vacío.
Ejercicio 7.6.8:
Las moléculas de agua tendrían que entrar en contacto con el benzoato de sodio para disolverlo. Si algo de benzoato de sodio está completamente rodeado por ácido benzoico, permanecería sin disolver.
Ejercicio 7.6.9:
El ácido acético, CH 3 CO 2 H, contiene un enlace C=O polar, un grupo O-H con enlaces de hidrógeno y una relación carbono:oxígeno de 1:1. Todos estos factores lo hacen relativamente polar.
Ejercicio 7.6.10:
- El THF está en la capa de agua.
- El THF está en la capa de éter.
a) La salmuera hace que la capa de agua sea aún más polar. El THF ya está al borde de ser soluble en agua, porque tiene una relación carbono:oxígeno de 4:1. La polaridad añadida del agua la empuja más allá del punto de inflexión.
Ejercicio 7.6.11:
Después de una extracción, la mitad del ácido perfluorobutanoico permanecería en el agua. Una segunda extracción eliminaría la mitad del resto, dejando solo una cuarta parte de la cantidad original todavía en el agua. Una tercera extracción dejaría 12% del original en el agua; una cuarta extracción dejaría 6%; una quinta extracción dejaría 3%; una sexta extracción dejaría 1.5% una séptima extracción dejaría menos de 1%.
La idea aquí es que las extracciones múltiples suelen ser necesarias. Sin embargo, sería bastante inusual elegir la partición de solventes como método de purificación si un compuesto es así de soluble en agua.
Ejercicio 7.6.12:
- Parece que la mitad del éter se ha evaporado.
- Los flotadores blancos son probablemente el ácido bezoico que solía disolverse en el éter. Ya no tienes suficiente éter para mantenerlo disuelto.
- Deberías agregar más éter antes de que este experimento empeore.
Ejercicio 7.7.1:
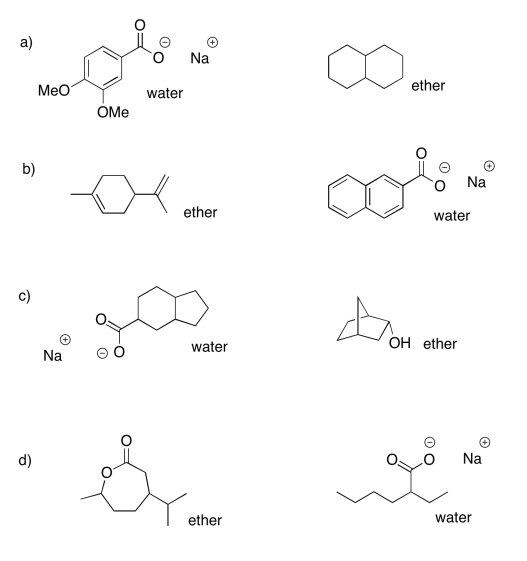
Ejercicio 7.7.2:
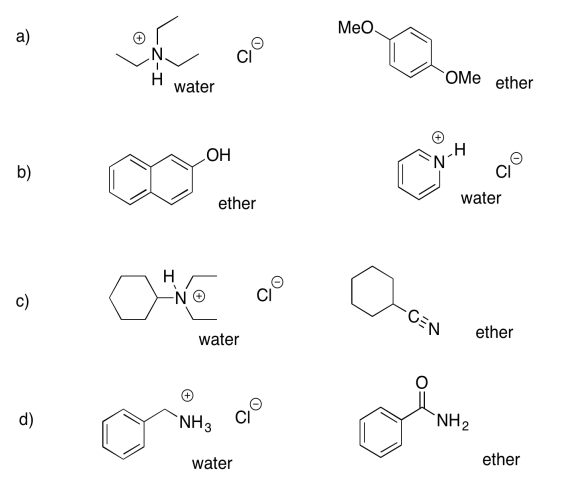
Ejercicio 7.7.3:
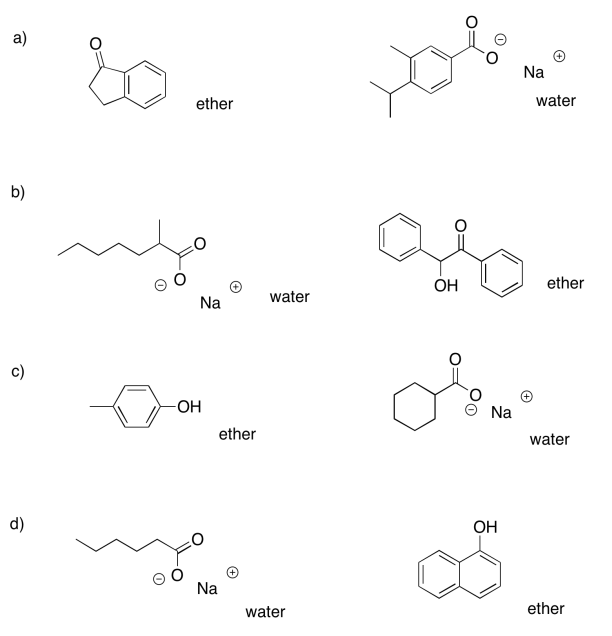
Ejercicio 7.7.4:
- éter: ciclohexanona; agua: octanoato de sodio
- éter: éter dibencílico; agua: cloruro de bencilamonio
- éter: heptanoato de propilo; agua: fenolato de sodio
- éter: 2-octanol; agua: bromobenzoato de sodio
- éter: heptanal; agua: cloruro de trioctilamonio
- éter: 4-metoxifenol; agua: 3-nitrobenzoato de sodio
Ejercicio 7.7.5:
- acetato de etilo (arriba): decanal; agua (abajo): benzoato de sodio
- diclorometano (parte inferior): alcohol bencílico; agua (arriba): 4-bromofenolato de sodio
- éter (arriba): 3-heptanona; agua (abajo): cloruro de N, N-dimetilbencilamonio
- cloroformo (fondo): ácido benzoico, ácido 2-metilhexanoico; agua (arriba): nada
- éter (arriba): nada; agua (abajo): 2-etilheptanoato de sodio, 4-clorofenolato de sodio
- diclorometano (parte inferior): benzonitrilo, N, N-dimetiloctanamida; agua (arriba): nada
Ejercicio 7.8.1:
La celulosa contiene muchos grupos OH y puede formar enlaces de hidrógeno con las moléculas de agua.
Ejercicio 7.8.2:
Diferentes pigmentos tienen diferentes propiedades físicas. Algunos de ellos serán más solubles en agua que otros. Algunos de ellos se adherirán al papel con más fuerza que otros.
Ejercicio 7.8.3:
El pentano no es suficientemente polar. Debe agregar un poco de 2-butanona a su sistema de solventes.
Ejercicio 7.8.4:
La 2-butanona es demasiado polar. Debe agregar algo de pentano a su sistema de solventes.
Ejercicio 7.8.5:
Siguiendo el método TLC, probablemente querrás comenzar con una placa mucho más grande que la que usaste para tus pruebas iniciales. En lugar de poner un pequeño punto de muestra en el plato, podrías pintar una línea de muestra en todo el plato. Usarías exactamente el mismo sistema de disolventes para eluir la placa, ya que uno que encontraste que funcionaba bien a menor escala. Después de eluir el plato, rasparías las tres líneas (no manchas) que se habían separado en el plato. Se suspendería cada muestra en algún disolvente que sea bastante polar pero que se evapore fácilmente (tal vez la 2-butanona) y filtraría la sílice, luego evaporaría el disolvente. Se podría poner la muestra restante en un vial. repetir con las otras dos muestras separadas.
Ejercicio 7.9.1:
El método depende del tiempo adecuado para que los compuestos se diferencien entre sí a medida que se mueven por la columna. Si todos se mueven demasiado rápido, probablemente todos estén pasando demasiado tiempo en la fase móvil.
Ejercicio 7.9.2:
Sin flujo para mantener las moléculas avanzando, los compuestos probablemente se difundieron en todas las direcciones mientras estaban en la fase móvil. Después de algún tiempo, algunos compuestos probablemente se habían extendido por toda la columna.
Ejercicio 7.9.3:
- En lugar de tener una fina capa de muestra al principio, comenzamos con una capa muy ancha. Como resultado, para cuando algunas moléculas de un compuesto estaban emergiendo de la parte inferior de la columna, otras apenas comenzaban al principio. Las moléculas de otros compuestos ya estaban muy por delante de ellos y no pudieron ponerse al día.
- Ella mantuvo todas las moléculas juntas al principio para que las moléculas de un compuesto permanecieran todas juntas y llegaran al final de la comlumn al mismo tiempo.
Ejercicio 7.9.4:
No. El disolvente es más polar que la fase estacionaria en este caso, por lo que más compuestos polares pasarán más tiempo en la fase móvil. Como resultado, los compuestos más polares en realidad se eluirán antes que los compuestos menos polares.
Ejercicio 7.10.1:
p-metoxifenol, luego p-dimetoxibenceno, luego p-dimetilbenceno
Ejercicio 7.10.2:
Los compuestos no están pasando mucho tiempo en la fase móvil, y tienen una afinidad mucho mayor por la fase estacionaria no polar; utilizan más acetonitrilo y menos agua en la fase móvil.
Ejercicio 7.10.3:
- bencilamina luego butilbenceno
- 2-decanol luego ácido decanoico
- 1-heptanol y luego 1-hepteno
- octanal luego metil octy éter
Ejercicio 7.11.1:
- brazzeína luego aspartamo
- rubsico luego tripsina
- titina luego insulina
- el poliestireno MW 100,000 luego el poliestireno MW 10,000

