6.2: Avogadro y Lunares, Tabla Periódica, Isótopos y Combustión
- Page ID
- 79922
Avogadro y topos
Al equilibrar una reacción o determinar su rendimiento, era muy importante realizar un seguimiento del número de cada tipo de átomo antes y después de la reacción. Los átomos pueden ser difíciles de explicar en la vida real debido a su minúsculo tamaño. En cambio, solemos hacer un seguimiento en moles: un mol consiste en el número de átomos (o moléculas) de Avogadro, o\(6.022 \times 10^{23}\) átomos o moléculas por mol.
Críticamente, podemos convertir de moles a un valor que es fácil de medir en un laboratorio: la masa. La masa molar de una sustancia se define como el número de gramos en un mol de esa sustancia. La masa molar de un solo elemento también se llama masa atómica; la masa molar de un compuesto se puede obtener sumando la masa molar de los elementos constituyentes.
Ejemplo: ¿Cuántos moles de níquel hay en\(102 \mathrm{~g}\) níquel? ¿Cuántos moles de\(\mathrm{H}_2 \mathrm{O}\) hay en\(50 \mathrm{~g}\) el agua?
\ begin {reunió}
102\ mathrm {~g}\ mathrm {Ni}\ veces\ dfrac {1\ mathrm {~mol}\ mathrm {Ni}} {58.69\ mathrm {~g}\ mathrm {Ni}} =1.74\ mathrm {~mol}\ mathrm {Ni}\\
50\ mathrm {~g}\ mathrm {H} _2\ mathrm {O}\ veces\ dfrac {1\ mathrm {~mol}\ mathrm {H} _2\ mathrm {O}} {(15.999+2\ veces 1.0107)\ mathrm {g}\ mathrm {H} _2\ mathrm {O}} =2.77\ mathrm {~mol}\ mathrm {H} _2\ mathrm {O}
\ end {reunidos}
Tabla Periódica
¡La tabla periódica es nuestra clave para resolver problemas! Contiene una gran cantidad de información que podemos utilizar para comprender y calcular las propiedades de los materiales. Los elementos están organizados por el número de protones: las filas se llaman periodos, y las columnas se llaman grupos. Los átomos están formados por protones cargados positivamente, neutrones neutros y electrones cargados negativamente. Los protones y neutrones viven en el centro del átomo: juntos, estos son la principal fuente de masa. Los electrones orbitan alrededor de los protones y neutrones (más sobre esto más adelante). Aquí se muestra un modelo de carbono de Bohr de ejemplo:
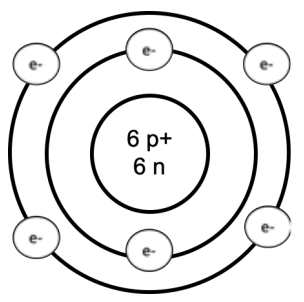
Podemos leer muchas propiedades de los átomos de la tabla periódica: Un átomo tiene el mismo número de protones
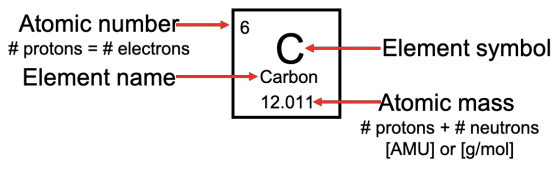
y electrones. La masa atómica es la suma del número de protones y neutrones: es la masa promedio de un átomo de cada elemento. Las unidades de masa atómica son AMU (unidades de masa atómica,\(=1 / 12\) la masa de un isótopo carbono-12), o equivalentemente (debido a una convención conveniente), el número de gramos en un mol de una sustancia.
Isótopos
Es posible que hayas notado que las masas atómicas en la tabla periódica no son números enteros, aunque el número de protones\(+\) neutrones debe ser un número entero. El número representado como masa atómica es realmente la masa atómica promedio, donde se toma un promedio ponderado sobre los posibles isótopos de un átomo. Un isótopo es un átomo que tiene algunos neutrones adicionales (o faltantes), y por lo tanto una masa atómica diferente. Los isótopos suelen escribirse así:
\({ }_Z^A X\)
Aquí,\(\mathrm{X}\) está el símbolo del elemento,\(\mathrm{Z}\) es el número atómico, y\(\mathrm{A}\) es la masa atómica. El número de neutrones en el isótopo es solo
\(\# \text { neutrons }=A-Z\)
Ejemplo: Complete la siguiente tabla:
| Isótopo | Abundancia | Masa atómica (amu) |
|---|---|---|
| \({ }^{28} \mathrm{Si}\) | \(92.18\%\) | \(28\) |
| \({ }^{29} \mathrm{Si}\) | ? | \(29\) |
| \({ }^x \mathrm{Si}\) | \(3.12\%\) | ? |
De la tabla periódica, la masa atómica promedio del silicio es\(28.0855\) amu. Primero, podemos resolver para el porcentaje de\({ }^{29} \mathrm{Si}\) usando el hecho de que la abundancia total debe sumar a\(100 \%\):
\ begin {reunió}
100\ %=92.18\ %+3.12\ %+y\\
y=4.71\%
\ end {reunido}
Entonces, podemos usar un promedio ponderado para calcular la masa atómica y determinar cuál es el tercer isótopo:
\ comenzar {reunido}
28.0855=0.9218\ tiempos (28 a m u) +0.0471\ veces (29 a m u) +0.0312 x\\
x=30
\ fin {reunidos}
Combustión
Una reacción de combustión ocurre cuando una sustancia reacciona con el gas oxígeno, produciendo luz y calor.
Ejemplo: Si pones\(400 \mathrm{~g}\) azúcar (glucosa) en una\(1 \mathrm{~m}^3\) caja, la prendes fuego y sellas rápidamente la caja, ¿habría suficiente oxígeno para quemarlo por completo? Escribir una reacción equilibrada; determinar el reactivo limitante y rendimiento.
Densidad del aire: Porcentaje en peso de\(1.225 \mathrm{~g} / \mathrm{L}=1.225 \mathrm{~kg} / \mathrm{m}^3\)
oxígeno en el aire: Fórmula\(23.2 \%\)
química de la glucosa:\(\mathrm{C}_6 \mathrm{H}_{12} \mathrm{O}_6\)
Podemos tratar de igualar el número de moles en la glucosa ajustando los coeficientes en el lado derecho. Esto da el número correcto de\(\mathrm{C}\) y\(\mathrm{H}\). Finalmente, podemos ajustar el coeficiente sobre el oxígeno para obtener una reacción equilibrada:
\(\mathrm{C}_6\mathrm{H}_{12}\mathrm{O}_6 + 6\mathrm{O}_2 \rightarrow 6\mathrm{CO}_2 + 6\mathrm{H}_2\mathrm{O}\)
Para determinar el reactivo limitante, necesitamos averiguar cuántos moles de cada reactivo tenemos:
400 g de glucosa\(\times \dfrac{1 \mathrm{~mol} \text { glucose }}{(6 \times 12.0107+12 \times 1.01+6 \times 15.999) \text { g glucose }}=2.22 \mathrm{~mol}\) glucosa
A continuación, necesitamos determinar cuánto oxígeno hay en la caja:
\(1 m^3 \text { air } \times \dfrac{1.225 \mathrm{~kg} \text { air }}{1 m^3 \text { air }} \times \dfrac{1000 g}{k g} \times 0.232 \times \dfrac{1 \text { mol oxygen }}{2 \times 15.999 \text { g oxygen }}=8.88 \text { mol oxygen }\)
donde la multiplicación por para\(0.232\) dar cuenta del hecho de que el aire es\(23.2 \%\) oxígeno.
Necesitamos 6 veces más oxígeno que glucosa para reaccionar completamente, y, por lo tanto\(6.66 / 2.22 \leq 6\), el oxígeno es el reactivo limitante. Podemos usar el reactivo limitante para calcular el rendimiento:
\(8.88 \mathrm{~g} \mathrm{O}_2 \times \dfrac{1 \mathrm{~mol} \mathrm{H}_2 \mathrm{O}}{1 \mathrm{~mol} \mathrm{O}_2} \times \dfrac{(2 \times 1.01+15.999) \mathrm{g} \mathrm{H}_2 \mathrm{O}}{1 \mathrm{~mol} \mathrm{H}_2 \mathrm{O}}=158.8 \mathrm{~g} \mathrm{H}_2 \mathrm{O}\)

