6.3: Olas, fotones y modelo Bohr
- Page ID
- 79998
Olas y fotones
Los fotones son cuantos de luz: la energía de un fotón con frecuencia\(\nu\) (o longitud de onda\(\lambda\)) viene dada por la relación Planck-Einstein.
\(E=h \nu=\dfrac{h c}{\lambda}\)
Aquí,\(\mathrm{h}\) es la constante de Planck, y\(\mathrm{c}\) es la velocidad de la luz. El espectro electromagnético se muestra aquí:
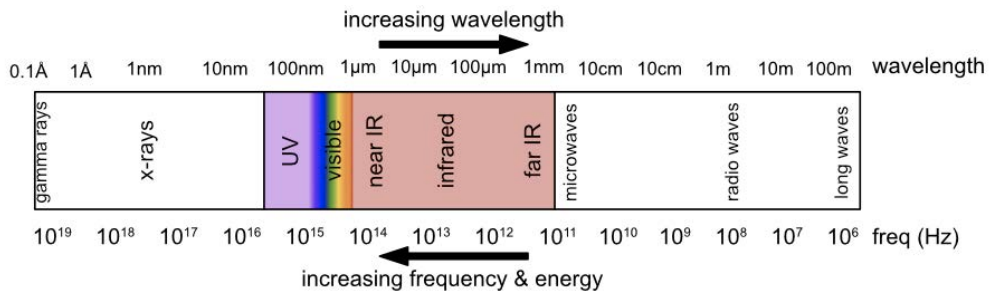
Recordemos que la igualdad anterior vino del hecho de que la frecuencia y la longitud de onda se relacionan a través de la velocidad de la luz como\(c=\lambda \nu\). También es importante recordar que la energía de un fotón es independiente de la amplitud de la onda:
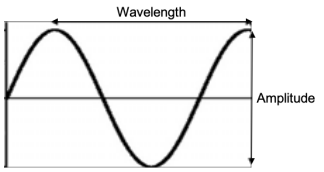
La energía se establece por la longitud de onda (o equivalentemente, frecuencia); la amplitud de la onda está relacionada con su intensidad: esto puede pensarse como el número de fotones de una determinada energía.
Ejemplo: Una estación de radio emite en\(100.7 \mathrm{MHz}\) con una potencia de salida de\(50 \mathrm{~kW}\). ¿Cuántos fotones se emiten cada segundo? Recordemos eso\(1 W=1 J / s\).
La energía por segundo que sale de la estación de radio es
\(50 \mathrm{~kW} \times \dfrac{1000 \mathrm{~W}}{1 \mathrm{~kW}} \times \dfrac{1 \mathrm{~J} / \mathrm{s}}{1 \mathrm{~W}}=5 \times 10^4 \mathrm{~J} / \mathrm{s}\)
Podemos calcular la energía por fotón con la relación Planck-Einstein:
\(E=h \nu=\left(6.626 \times 10^{-34} \mathrm{~J}^* \mathrm{~s}\right) \times\left(100.7 \times 10^6 \mathrm{~s}^{-1}\right)=6.672 \times 10^{-26} \mathrm{~J} / \text { photon }\)
Finalmente, el número de fotones por segundo es
\(N=\left(5 \times 10^{-4} \mathrm{~J} / \mathrm{s}\right) \dfrac{1 \text { photon }}{6.672 \times 10^{-26} \mathrm{~J}}=7 \times 10^{29} \text { photons } / \mathrm{s}\)
Modelo Bohr
El efecto fotoeléctrico nos dice que brillar luz con suficiente energía sobre un átomo puede provocar la emisión de electrones. En\(3.091\), usaremos el modelo Bohr para modelar este proceso. En el modelo Bohr, un electrón en un átomo de hidrógeno solo puede vivir en niveles discretos de energía, con los que etiquetamos\(n\). El nivel de energía más bajo es el estado fundamental, con\(n=1\). El cambio en la energía correspondiente a la transición de un nivel de energía inicial,\(n_i\) a un nivel de energía final,\(n_f\) viene dado por
\(\Delta E=-13.6\left(\dfrac{1}{n_f^2}-\dfrac{1}{n_i^2}\right)[e V]\)
Si un fotón con la energía justa incide sobre el átomo, el fotón puede ser absorbido y el electrón excitado a un nivel de energía superior.
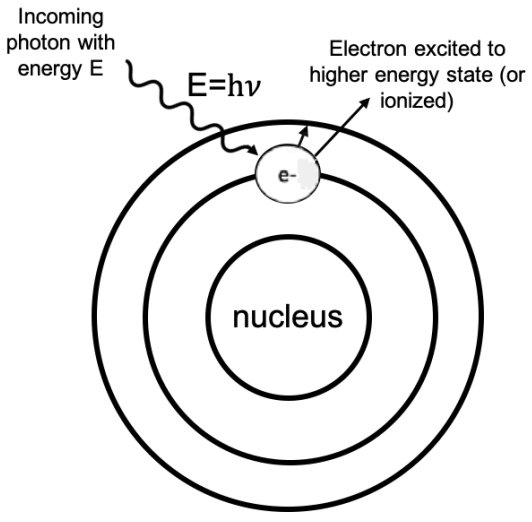
Por el contrario, si un electrón se relaja de un nivel de energía superior a uno inferior dentro del átomo,\(\nu=\Delta E / h\) se libera un fotón con frecuencia.
Ejemplo: Una fuente de alimentación emite\(8 \times 10^{18}\) fotones/s en\(10 \mathrm{~W}\). Determinar cuánta energía tiene cada fotón. Entonces, calcula en qué estado terminaría un electrón en el estado fundamental de un átomo de hidrógeno si fuera excitado por un fotón con esta energía.
Para calcular la energía de cada fotón, podemos utilizar el análisis dimensional para llegar a Julios:
\(E=\dfrac{10 \mathrm{~J} / \mathrm{s}}{5 \times 10^{18} \text { photons } / \mathrm{s}} \times \dfrac{1 \mathrm{eV}}{1.6 \times 10^{-19} \mathrm{~J}}=12.5 \mathrm{eV}\)
Si el electrón comienza en el estado fundamental, tenemos que resolver
\(\Delta E=12.5 \mathrm{eV}=-13.6 \mathrm{eV}\left(\dfrac{1}{n_f^2}-\dfrac{1}{1^2}\right) \quad n_f=3.51\)
Dado que el electrón debe vivir en un estado entero, debe o bien ir al tercer o cuarto nivel. Se necesitaría más energía de la que tenemos para llegar al cuarto nivel energético, el nivel energético más alto accesible es\(n=3\).

