6.5: Números cuánticos
- Page ID
- 79885
Números cuánticos
Cada electrón localizado en un átomo puede ser descrito por cuatro números cuánticos. El Principio de Exclusión Pauli nos dice que no hay dos electrones que puedan compartir exactamente el mismo conjunto de números cuánticos
Número cuántico principal
El número cuántico principal,\(n\), representa el nivel de energía del electrón, al igual que el\(n\) utilizado en el modelo Bohr. La energía está relacionada con el número cuántico principal por
\(E=-\dfrac{13.6 \mathrm{eV}}{n^2}, \quad n>0\)
Número cuántico de momento angular orbital
El número cuántico de momento angular orbital\(l\),, proporciona información sobre la forma de un orbital. A diferencia de la descripción de los primeros modelos del átomo, los electrones en los átomos no orbitan alrededor del núcleo como un planeta alrededor del sol. Sin embargo, sí tienen momento angular, y la forma de la nube de probabilidad alrededor del núcleo depende del valor del momento angular. La magnitud del momento angular está relacionada con el número cuántico de momento angular orbital por
\(L=\hbar \sqrt{l(l+1)}, \quad 0 \leq l \leq n-1\)
Los números cuánticos de momento angular orbital corresponden directamente a letras comúnmente utilizadas por los químicos para describir las subconchas orbitales: por ejemplo,\(l=1\) corresponde a los\(\mathrm{s}\) orbitales, que son esféricos:
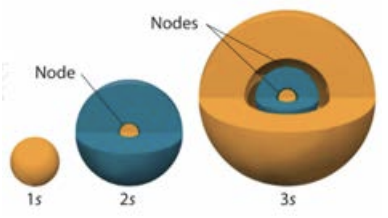
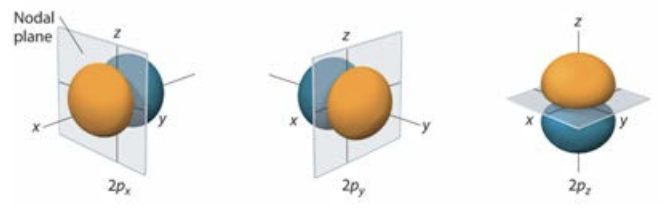
\(l=2\)corresponde a los\(\mathrm{p}\) orbitales, los cuales son lobulados: Visualizaciones de los orbitales superiores, como los\(\mathrm{d}(l-2)\)
y se\(f (l = 3)\) puede encontrar en el Capítulo 6 del libro de texto Averill.
Número cuántico magnético
El número cuántico magnético\(m\),, distingue los orbitales disponibles dentro de una subcapa. La proyección del momento angular sobre el\(\mathrm{z}\) eje está relacionada con el número cuántico magnético por
\(L_z=m \hbar, \quad-l \leq m \leq l\)
Número cuántico de giro
El número cuántico de espín\(m_s\),, da el momento angular de giro de cada electrón. Cada electrón puede ser spin up o spin down. La magnitud del giro es\(+1 / 2\) (spin up) o\(-1 / 2\) (spin down). La magnitud del momento angular asociado con el giro es
\(|S|=\hbar \sqrt{s(s+1)}\)
y la proyección de giro sobre el\(\mathrm{z}\) eje viene dada por
\(S_z=s \hbar\)
La restricción sobre los valores permitidos de spin es
\(s=\pm \dfrac{1}{2}\)
Ejemplo: ¿Cuál es la configuración electrónica del carbono? Escribe los números cuánticos para cada electrón.
- Contestar
-
El carbono tiene seis electrones de valencia. Comenzaremos a llenar los números cuánticos siguiendo las reglas anteriores. A partir de\(n=1\), el único valor posible de\(l\) es\(l=0\), ya que\(0 \leq l \leq n-1\). Cuando también\(l=0, m\) debe ser 0. Hay dos posibles giros que podrían ir con estos números cuánticos. No hay más números cuánticos disponibles con\(n=1\), así que debemos subir a un caparazón más alto. Para\(n=2\), el estado de energía más bajo corresponde a la menor magnitud de momento angular,\(l=0\), que nuevamente requiere\(m=0\).
Para los dos últimos electrones, tenemos que recordar la regla de Hund. Cada orbital en una subcapa debe estar ocupado individualmente con electrones de un giro antes de agregar electrones del otro. Entonces los\(l=1\) electrones deben tener diferentes valores de\(m\), pero el mismo valor de\(m_s\). Los números cuánticos se resumen en la siguiente tabla.
\ [\ begin {array} {c|c|c|c}
n & l & m & m_s\\ hline
\ hline 1 & 0 & 0 & 1/2\\
1 & 0 & 0 & 0 & 0 & -1/2\\
2 & 0 & 0 & 1/2\
2 & 0 & 0 & 0 & -1/2\\
2 & 1 & 0 & 1/2\\
2 & 1 & -1 & 1/2
\ end {array}\ nonumber\]

