6.7: Tendencias periódicas, diagramas de puntos de Lewis y carga formal
- Page ID
- 79947
Tendencias periódicas
Dentro de un átomo, los electrones cargados negativamente son atraídos por el núcleo cargado positivamente, pero se repelen entre sí. Los electrones cercanos al núcleo pueden proteger a los electrones más externos de las fuerzas de Coulomb entre los electrones y el núcleo.
Al cruzar una fila en la tabla periódica, cada elemento tiene un electrón extra y un protón extra. El protón adicional tiene un fuerte efecto sobre los electrones, ya que el número de electrones de blindaje interno no cambia. Sin embargo, al bajar un periodo, cada vez hay más conchas de electrones con energía creciente y radio promedio desde el núcleo. Por lo tanto, el radio atómico disminuye de izquierda a derecha a través de las filas de la tabla periódica, y aumenta de arriba a abajo.
Cuando los átomos se ionizan, su radio atómico cambia a medida que cambia el equilibrio del estado de carga. Si un átomo gana electrones para que se carguen negativamente, se le llama anión. Si un átomo pierde electrones para llegar a ser cargado positivamente, se le llama catión. Los cationes suelen ser más pequeños que la versión neutra del átomo, mientras que los aniones suelen ser más grandes. Un sólido iónico contiene cationes y aniones en una proporción que mantiene la neutralidad de carga.
Ejemplo: Organizar\(\mathrm{Al}, \mathrm{C}\), y\(\mathrm{Si}\) en orden de aumentar el radio atómico.
- Contestar
-
El carbono se encuentra en el segundo periodo de la tabla periódica, mientras que\(\mathrm{Al}\) y\(\mathrm{Si}\) están en el tercero:\(\mathrm{C}\) debe ser el más pequeño. \(\mathrm{Al}\)está en el grupo III, mientras que\(\mathrm{Si}\) está en el grupo IV, por lo que\(\mathrm{Al}\) es probable que sea mayor que\(\mathrm{Si}\) debido al efecto relativamente fuerte del protón extra que\(\mathrm{Si}\) tiene.
(más pequeño)\(\quad \mathrm{C} \rightarrow \mathrm{Si} \rightarrow \mathrm{Al} \quad\) (más grande)
Diagramas de punto Lewis
Los diagramas de puntos de Lewis son una herramienta utilizada para visualizar los electrones de valencia en átomos. Entonces, al emparejar electrones, podemos visualizar posibles formas en que se pueden formar enlaces entre dos átomos.
Hay un par de reglas generales que resultan útiles a la hora de dibujar diagramas de puntos de Lewis. La regla del octeto nos dice que los átomos ganan, pierden o comparten electrones para tener una capa de valencia completa de 8 electrones (2 para\(\mathrm{H}\) y\(\mathrm{He}\)). Además, el número de electrones de valencia en un átomo es igual al número de grupo. Por lo general, podemos comenzar siguiendo estos pasos:
1. Determinar el número de electrones de valencia en cada átomo en el compuesto
2. Colocar un par de enlace entre los átomos adyacentes
3. A partir de átomos terminales, añadir electrones para formar octetos
Ejemplo: Dibuje diagramas de puntos de Lewis para los siguientes compuestos:\(\mathrm{CH}_4, \mathrm{CCl}_4, \mathrm{CO}_2\), y\(\mathrm{OH}^{-}\)
- Contestar
-
\(\mathrm{CH}_4\):\(\mathrm{C}\) tiene 4 electrones de valencia (grupo IV), mientras que el hidrógeno solo tiene uno. Compartir cuatro electrones entre los\(\mathrm{C}\) y\(\mathrm{H}\) produce un octeto en el átomo de carbono y una capa completa de dos electrones en el hidrógeno. Tenga en cuenta que a menudo es conveniente poner el átomo que tiene los electrones más desapareados en el medio.
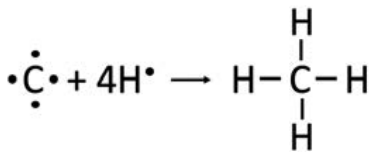
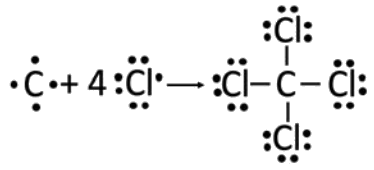
\(\mathrm{CCl}_4\): De nuevo,\(\mathrm{C}\) tiene electrones de\(4\) valencia, y\(\mathrm{Cl}\) tiene\(7\). \(\mathrm{Cl}\)sólo puede ganar un electrón adicional para tener un octeto completo, por lo que cada uno\(\mathrm{Cl}\) solo hace un enlace. Por lo tanto, podemos volver a poner\(\mathrm{C}\) en el medio y rodearlo de\(\mathrm{Cl}\) átomos, y cada átomo tiene un octeto completo.
\(\mathrm{CO}_2\):\(\mathrm{C}\) tiene 4 electrones de valencia, mientras que\(\mathrm{O}\) tiene 6. Podemos comenzar colocando el\(\mathrm{C}\) en el medio y formando un enlace con cada uno\(\mathrm{O}\). La estructura que resulta es inestable, debido a que cada uno\(\mathrm{O}\) se queda con un electrón desapareado. \(\mathrm{C}\)también tiene dos electrones desapareados sobrantes. Podemos utilizarlos para formar dobles enlaces entre el\(\mathrm{C}\) y cada uno\(\mathrm{O}\) sin violar la regla del octeto. Tenga en cuenta que cada uno\(\mathrm{O}\) se queda con dos pares solitarios.
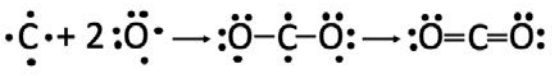
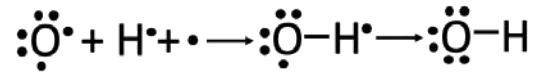
\(\mathrm{OH}^{-}\): Aquí, el oxígeno trae 6 electrones de valencia y el\(\mathrm{H}\) trae solo uno, pero hay un electrón adicional en juego debido a la carga negativa general de la estructura. Después de formar un enlace sencillo entre el\(\mathrm{O}\) y el\(\mathrm{H}\), nos quedamos con electrones desapareados, así que necesitamos reorganizar un poco más. No podemos hacer un doble enlace al hidrógeno, ya que sólo puede soportar dos electrones. Mover el electrón extra al oxígeno para unirse a un par solitario hace el truco.
Cargo formal
Arriba, discutimos los pasos para construir diagramas de puntos de Lewis: siguiendo estas reglas, podemos determinar configuraciones electrónicas estables de moléculas. También podemos cuantificar esta estabilidad calculando la carga formal.
\(\text { Formal Charge }=\# \text { valence } e^{-} \mathrm{s}-\left(N+\dfrac{b}{2}\right)\)
donde el número de electrones de valencia se refiere al átomo neutro aislado,\(N=\) el número de electrones de valencia no unidos y\(b=\) el número de electrones de valencia que participan en enlaces. Se debe calcular la carga formal para cada átomo de la molécula.
Ejemplo: Determinar el cargo formal de\(\mathrm{CO}_2\).
- Contestar
-
Oxígeno: el átomo de oxígeno neutro aislado tiene 6 electrones de valencia. Cada oxígeno\(\mathrm{CO}_2\) tiene 4 electrones no enlazantes y 4 electrones almacenados en enlaces.
\[\text { Formal Charge (Oxygen) }=6-\left(4+\dfrac{4}{2}\right)=0 \nonumber\]
Carbono: el átomo de carbono neutro aislado tiene 4 electrones de valencia. Cada carbono\(\mathrm{CO}_2\) tiene 8 electrones almacenados en enlaces.
\[\text { Formal Charge }(\text { Carbon })=4-\left(\dfrac{8}{2}\right)=0 \nonumber\]

