6.8: Resonancia y Carga Formal (cont.)
- Page ID
- 79973
Resonancia
A menudo, hay muchas formas en que los electrones se pueden organizar alrededor de una molécula. La existencia de múltiples configuraciones electrónicas que son estables conduce a la resonancia, que describe la deslocalización de electrones en moléculas unidas covalentemente. Para ser consideradas estructuras de resonancia, las moléculas deben cumplir con los siguientes criterios:
1. Los átomos deben estar en la misma orientación entre sí
2. Todas las estructuras de resonancia deben tener el mismo número de electrones de valencia
3. Debe cumplirse la regla del octeto, con algunas excepciones:
- No le siguen algunos elementos en periodos tres y superiores, incluyendo\(\mathrm{Cl}, \mathrm{Br}, \mathrm{I}, \mathrm{P}, \mathrm{Si}\)
- El azufre puede tener hasta\(12 \mathrm{e}^{-}\)
- El boro puede tener\(6 \mathrm{e}^{-}\)
4. La carga formal debe estar en los átomos más electronegativos
Ejemplo: Dibujar estructuras de resonancia para ozono\(\left(\mathrm{O}_3\right)\) y\(\mathrm{CO}_3^{2-}\).
- Contestar
-
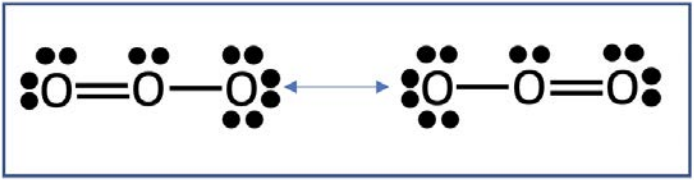
El ozono consta de tres átomos de oxígeno, para un total de 18 electrones de valencia. Estos pueden distribuirse de manera equivalente de dos maneras:
\(\mathrm{CO}_3^{2-}\)consiste en un átomo de carbono central que trae 4 electrones de valencia, y cuatro átomos de oxígeno que traen 6 electrones cada uno, y dos electrones adicionales que producen la\(2^{-}\) carga adicional. Las estructuras de resonancia se pueden representar de la siguiente manera:
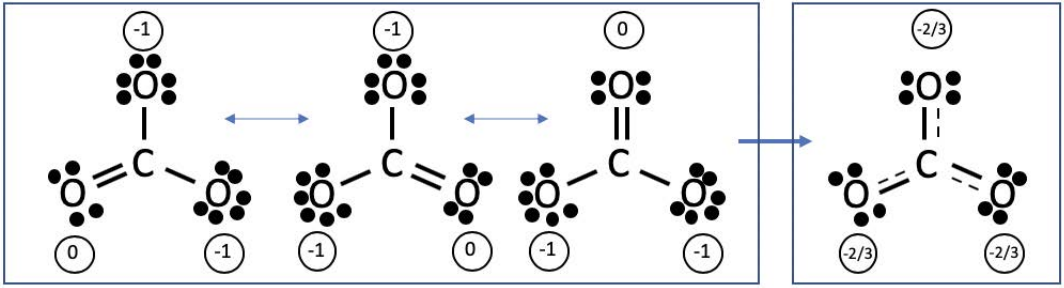
Estas estructuras equivalentes se pueden combinar en una imagen compacta (mostrada arriba a la derecha) que es un promedio de las estructuras posibles. Todas las estructuras de resonancia son igualmente probables, ya que satisfacen de manera equivalente las pautas para estructuras estables de Lewis.
Cargo formal (otra vez)
En el\(\mathrm{CO}_3^{2-}\) ejemplo anterior, la carga formal sobre cada átomo se muestra en círculos. La carga formal sólo aparece en el oxígeno, ya que el oxígeno es más electronegativo que el carbono. En la estructura promedio, la carga formal se promedia sobre todos los átomos de oxígeno. Podemos verificar que tenemos la estructura de resonancia más estable evaluando la carga formal en varias opciones. La estructura de resonancia con la carga formal más baja en cada átomo es la más estable y ocurrirá con mayor probabilidad sobre otras estructuras de resonancia. Como recordatorio, el cargo formal se calcula usando
\(=\#\)Valencia de carga formal\(e^{-} \mathrm{s}-\left(N+\dfrac{b}{2}\right)\)
donde el número de electrones de valencia se refiere al átomo neutro en aislamiento,\(N=\) el número de electrones de valencia no enlazantes y\(b=\) el número de electrones de valencia que participan en enlaces. Se debe calcular la carga formal para cada átomo de la molécula.
Ejemplo: Encontrar tres estructuras de resonancia de\(\mathrm{CO}_2\), y determinar cuál es la más estable.
- Contestar
-
Última recitación, dibujamos una posible estructura electrónica de\(\mathrm{CO}_2\). Aquí se dan dos más:
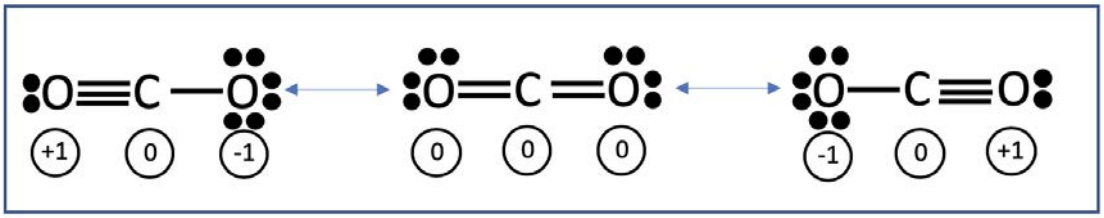
Se muestra la carga formal de cada átomo en cada una de las tres estructuras de resonancia viables. Aunque cada estructura de resonancia satisface las reglas de diagramas de puntos de Lewis válidos y estructuras de resonancia viables, la estructura central es la más estable ya que la carga formal es la más baja.

