6.9: VSEPR y Polaridad
- Page ID
- 79934
VSEPR
Las estructuras de puntos de Lewis son una gran herramienta para visualizar cómo se pueden organizar los electrones en moléculas. Además, dibujar estructuras de resonancia y determinar la carga formal puede ayudarnos a determinar qué estructuras son más estables. Sin embargo, ninguna de estas herramientas proporciona mucha información sobre la configuración física de una molécula en el espacio 3D. Para ello, pasamos a V alence S hell E lectron P air R epulsion theory, o VSEPR.
Una vez que dibujamos una estructura de Lewis viable, podemos usar la siguiente tabla para traducir la representación 2D a una geometría 3D:
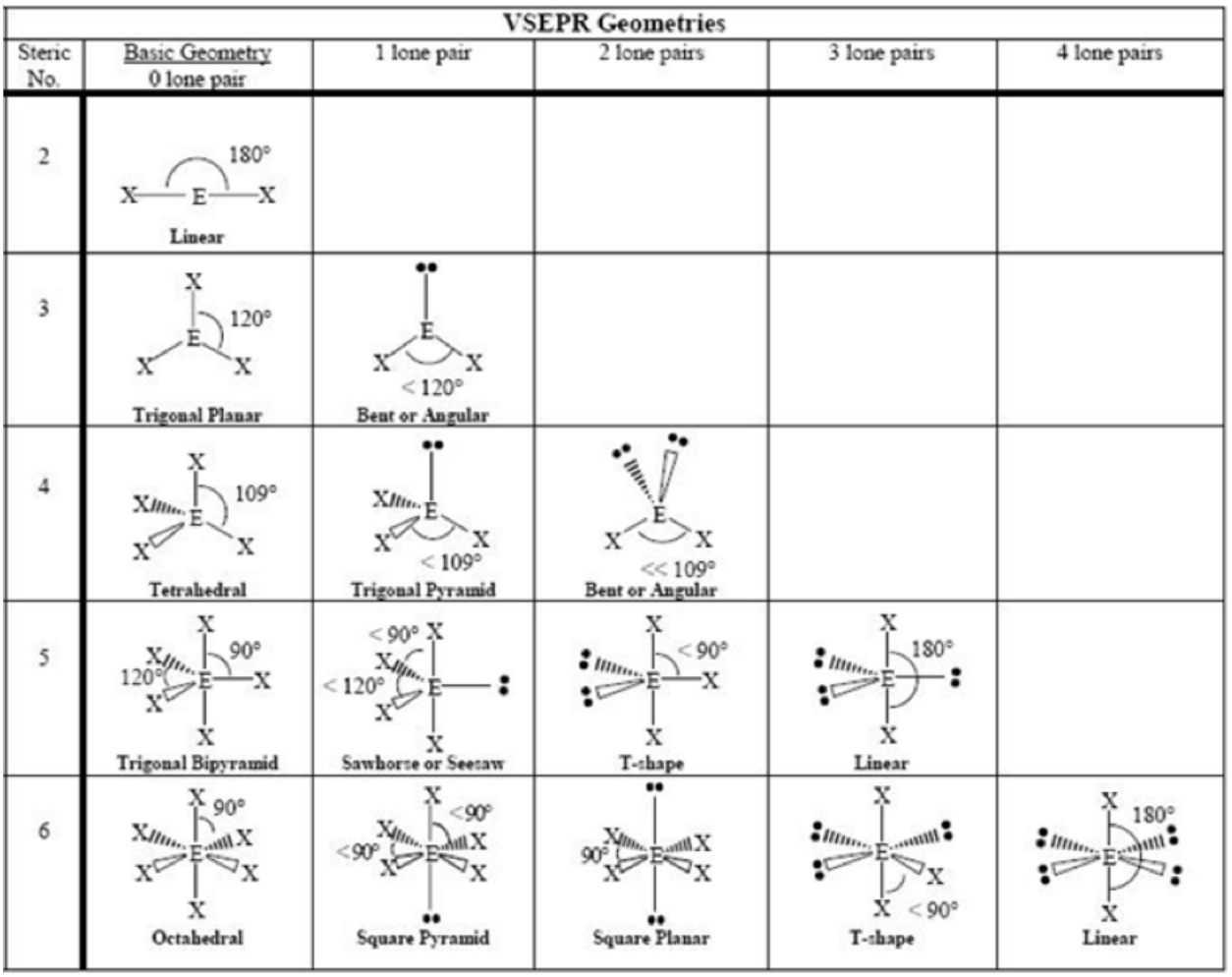
Gráfico cortesía de Boundless.com. Licencia: CC BY-SA. Este contenido está excluido de nuestra licencia Creative Commons. Para obtener más información, consulte https://ocw.mit.edu/fairuse.
Ejemplo: Dibuje diagramas de puntos de Lewis y determine la geometría 3D VSEPR de las siguientes moléculas:
\(\mathrm{CH}_4, \mathrm{NH}_3, \mathrm{H}_2 \mathrm{O}, \mathrm{SO}_3, \mathrm{SO}_2, \mathrm{CO}_2\)
- Responder
-
Diagrama de puntos de Lewis Electrones alrededor del átomo central Descripción de VESPR Croquis de modelo 3D \(\mathrm{CH}_4\) 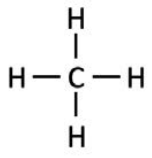
- 4 grupos de electrones en enlaces
- 0 pares solitarios
tetraédrico 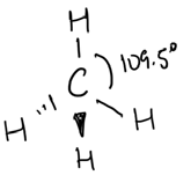
\(\mathrm{NH}_3\) 
-3 grupos de electrones en enlaces
-1 par solitario
piramidal trigonal 
\(\mathrm{H}_2\mathrm{O}\) 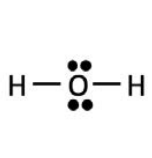
- 4 grupos de electrones en enlaces
- 0 pares solitarios
doblado 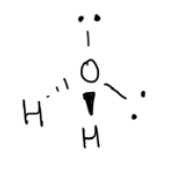
\(\mathrm{SO}_3\) 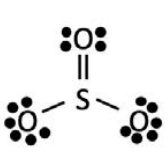
- 4 grupos de electrones en enlaces
- 0 pares solitarios
plano trigonal 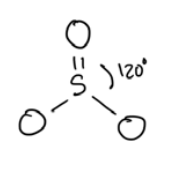
\(\mathrm{SO}_2\) 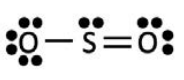
- 4 grupos de electrones en enlaces
- 0 pares solitarios
doblado 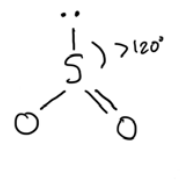
\(\mathrm{CO}_2\) 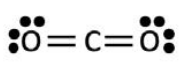
- 4 grupos de electrones
- 0 pares solitarios
lineal 
Polaridad
La diferencia en la electronegatividad a través de una molécula puede generar momentos dipolares eléctricos. Los momentos dipolares son cantidades vectoriales, y por punto de convención de una región de carga más positiva a una región más negativa. Si los dipolos individuales dentro de una molécula cancelan, no hay dipolo neto.
Ejemplo: Determinar si\(\mathrm{CO}_2\) y\(\mathrm{H}_2\mathrm{O}\) tener un momento dipolo neto.
- Responder
-
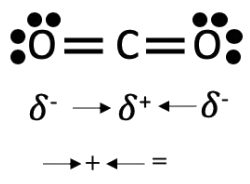
En\(\mathrm{CO}_2\), los dos dipolos electrónicos son exactamente opuestos y se cancelan entre sí, por lo que no hay un dipolo neto. El dióxido de carbono no es una molécula polar.
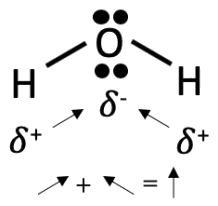
En\(\mathrm{H}_2\mathrm{O}\), los dipolos electrónicos no cancelan completamente, por lo que hay un momento dipolo neto. ¡El agua es una molécula polar!

