6.10: Hibridación, Orbitales Atómicos y Teoría Orbital Molecular
- Page ID
- 79972
Hibridación y orbitales atómicos
Los diagramas de puntos de Lewis y VSEPR son herramientas poderosas para pensar en la configuración electrónica y la forma molecular, pero ninguna herramienta ofrece una manera de predecir la estabilidad de los enlaces. La fuerza de un enlace covalente es proporcional a la cantidad de superposición entre orbitales electrónicos.
Considera\(\mathrm{BeH}_2\): el berilio aporta 2 electrones de valencia, y cada uno de los dos átomos de hidrógeno aporta un electrón de valencia.
\(\mathrm{H}-\mathrm{Be}-\mathrm{H}\)
Como recordatorio, la configuración electrónica del hidrógeno es\(1 \mathrm{~s}^1\), mientras que la configuración electrónica del berilio lo es\(1 \mathrm{~s}^2 2 \mathrm{~s}^2\). El caparazón de valencia de\(\mathrm{Be}\left(2 \mathrm{~s}^2\right)\) está lleno: tiene dos electrones, el máximo que puede vivir en un\(\mathrm{s}\) -orbital. No hay orbitales solo ocupados disponibles para formar enlaces con hidrógeno, a pesar de que predecimos a partir del diagrama de puntos de Lewis anterior que debería haber enlaces simples entre cada uno\(\mathrm{H}\) y el\(\mathrm{Be}\). Podemos dibujar la ocupación electrónica de los estados energéticos en el\(\mathrm{Be}\) átomo en función de la energía, y luego aplicar el principio de hibridación:
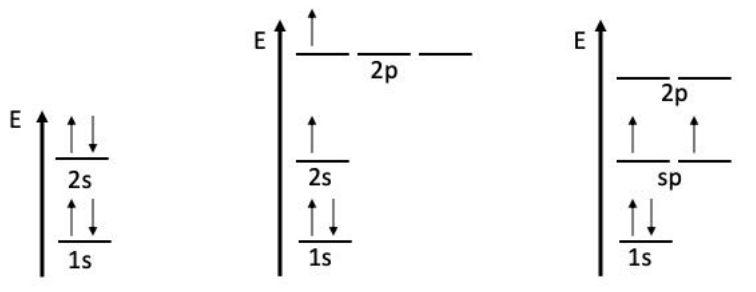
niveles de energía de la hibridación\(\quad \rightarrow \quad\) sp de\(\quad \rightarrow \quad\) promoción de átomos Be
Para sortear el tema del\(2 \mathrm{~s}\) caparazón completo, un electrón podría ser promovido a la\(2 \mathrm{~s}\) subcapa, dejando dos electrones que están listos para formar enlaces. Sin embargo, los\(2 \mathrm{p}\) electrones\(2 \mathrm{~s}\) y no son iguales: si este fuera el caso, los dos\(\mathrm{H}-\mathrm{Be}\) enlaces serían desiguales, lo que no tiene base física. En cambio, considere la tercera imagen: al combinar el\(2 \mathrm{s}\) orbital con una de las\(2 \mathrm{p}\) subconchas, se crea un nivel de energía\(\mathrm{sp}\) hibridado intermedio. Este orbital sp tiene dos subconchas de igual energía que permiten que se formen dos enlaces de energía iguales con el\(\mathrm{Be}\) átomo. Esto no es exclusivo de\(\mathrm{BeH}_2\): la\(\mathrm{sp}\) hibridación ocurre cada vez que una\(2 \mathrm{p}\) subcapa se combina con la\(2 \mathrm{~s}\) subcapa. Además, si hay más electrones disponibles para participar en la unión, la\(\mathrm{sp}^2\) hibridación (3 enlaces iguales), la\(\mathrm{sp}^3\) hibridación (4 enlaces iguales), o la hibridación de orden superior que implique\(\mathrm{d}\) -orbitales.
¡La hibridación se correlaciona directamente con la geometría molecular! La siguiente tabla muestra la equivalencia:
\ (\ begin {array} {c|c}
\ text {geometría molecular} &\ text {Hibridación}\
\ hline\ hline\ hline\ texto {lineal} &\ mathrm {sp}
\\ text {trigonal} &\ mathrm {sp} ^2
\\ texto {tetraédrico} &\ mathrm {sp} ^3\
\ texto {trigonal bipiramidal} &\ mathrm {sp} ^3\ mathrm {~d}\\
\ text {octaédrico} &\ mathrm {sp} ^3\ mathrm {~d} ^2
\ end {array}\)
Teoría de orbitales moleculares (MO)
Podemos usar la teoría orbital molecular para comprender mejor cómo los electrones forman enlaces y predecir propiedades como la estabilidad de los enlaces y el carácter magnético. En 3.091, aplicaremos\(\mathrm{MO}\) la teoría a los dímeros. Recordemos que todos los electrones están cargados negativamente: en el espacio libre, los electrones sentirían una fuerza repulsiva de otros electrones cercanos. Sin embargo, hay fuerzas adicionales dentro de un átomo que crean un ambiente que permite la concentración de densidad electrónica en enlaces. Al considerar cómo pueden interactuar dos electrones en un sólido, es útil pensar en la naturaleza de onda de los electrones. Dos electrones pueden interferir constructivamente para formar un enlace\(\mathrm{MO}\), o interferir destructivamente para formar un antienlace\(\mathrm{MO}\).
\(\mathrm{MO}\)Los diagramas son una herramienta conveniente para realizar un seguimiento de los orbitales de unión y antiadhesión y, por lo tanto, de la fuerza de unión. Podemos cuantificar la fuerza de unión calculando el orden de unión:
Orden de enlace\(=\dfrac{1}{2}\) (\(\#\)electrones en orbitales de unión\(-\#\) electrones en orbitales antiadherentes)
Si el orden de enlace es mayor que cero, se forma un dímero estable.
Si un dímero tiene electrones desapareados, es paramagnético: estos electrones desapareados se alinean con los campos magnéticos aplicados y son débilmente atraídos hacia el campo aplicado. Si todos los electrones están emparejados, los dímeros son repelidos por campos magnéticos aplicados, y los dímeros se llaman diamagnéticos.
Ejemplo: Dibujar un diagrama orbital molecular para el\(\mathrm{F}_2\) dímero. Calcular el orden de unión y determinar si es paramagnético o diamagnético.
- Contestar
-
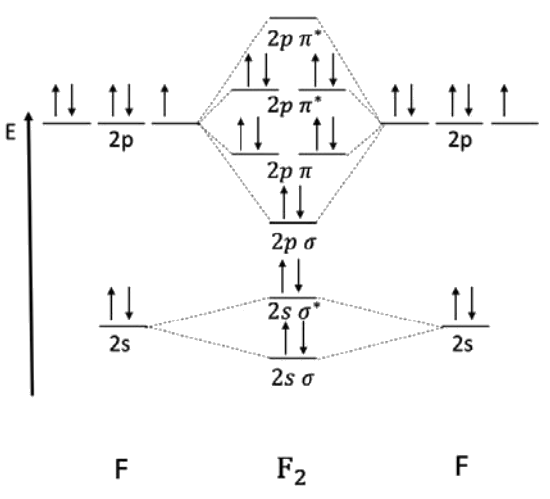
Comenzamos aquí dibujando los\(\mathrm{AO}\) diagramas de los electrones de valencia de cada uno de los\(\mathrm{F}\) involucrados en el\(\mathrm{F}_2\) dímero. Recordemos que F (Grupo VII) tiene 7 electrones de valencia. Luego, poblamos los orbitales\(\sigma\) ligantes y\(\sigma^*\) antiadherentes asociados con el caparazón de\(2 \mathrm{s}\) valencia. Luego, dibujamos los orbitales de\(2 \mathrm{p} \sigma\)\(\pi\) unión,\(\pi^*\) unión,\(\sigma^*\) antiadhesión y antiadhesión. Poblando desde la energía más baja hasta la energía más alta, hay suficientes electrones para llenar los orbitales\(2 p \pi^*\) antiadherentes.
Podemos calcular el orden de fianza usando la fórmula de arriba. Hay ocho electrones en los orbitales de unión y seis electrones en los orbitales antiadherentes:
\(\text { bond order }=\dfrac{1}{2}(8-6)=1\)
Todos los electrones están emparejados, por lo que el\(\mathrm{F}_2\) dímero es diamagnético.

