6.11: Más Teoría Orbital Molecular y Fuerzas Intermoleculares
- Page ID
- 79948
Más Teoría MO
Hasta el momento hemos discutido\(\mathrm{MO}\) diagramas con dímeros homogéneos: ambos átomos son iguales. Pero también puede haber dímeros heterogéneos que involucren dos átomos diferentes, ¡y estos dímeros pueden cargarse! Cuando construimos un\(\mathrm{MO}\) diagrama para un dímero heterogéneo, es el mismo principio que para un dímero homogéneo: dibujar diagramas orbitales electrónicos para cada átomo, poblar los estados electrónicos, y luego fil en los estados de unión sigma y pi y antiadhesión formados. La única diferencia en el caso del dímero heterogéneo es que debemos considerar la energía relativa de cada conjunto de orbitales atómicos. Esto a menudo produce\(\mathrm{MO}\) diagramas asimétricos. Por lo general, el átomo más electronegativo es menor en energía.
Ejemplo: Dibuja el\(\mathrm{MO}\) diagrama de\(\mathrm{CN}^-\). Determinar el orden de fianza.
- Contestar
-
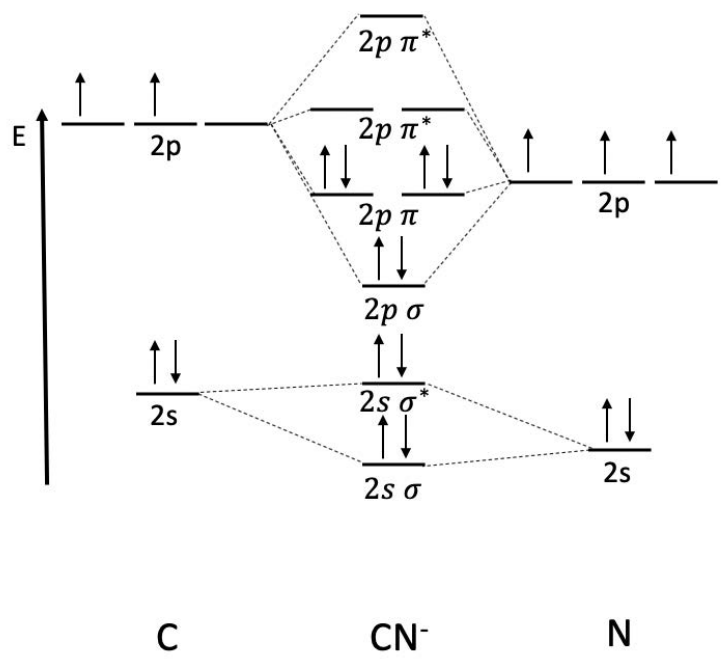
El nitrógeno es menor a lo largo del eje de energía porque es más electronegativo que el carbono, produciendo un\(\mathrm{MO}\) diagrama asimétrico. Hay 8 electrones en orbitales de unión y 2 electrones en orbitales antiadherentes, por lo que el orden de enlace es
\(\text { bond order }=\dfrac{1}{2}(8-2)=3\)
¡Un dímero con orden de enlace 3 es triple enlazado! Es posible que reconozcas esta molécula como cianuro.
Fuerzas intermoleculares (IMF)
Las Fuerzas de Dispersión de Londres (LDF) existen en todas las moléculas. A medida que los electrones distribuidos a través de una molécula fluctúan en el tiempo, generan pequeños campos eléctricos. Entonces, los electrones en otras moléculas o átomos que están en estrecha proximidad se reordenan en respuesta a los campos eléctricos generados. Las moléculas con más electrones experimentan LDF más fuertes.
Las interacciones dipolo-dipolo son IMF caracterizadas por la fuerza electrostática entre moléculas polares. Cuanto más polar es la molécula, más fuerte es la interacción.
Los enlaces de hidrógeno (\(\mathrm{H}\)-enlaces) son un tipo particular de interacción dipolo-dipolo que se producen en moléculas con un átomo de hidrógeno\((\mathrm{H})\) unido directamente a un átomo de flúor, oxígeno o nitrógeno (\(\mathrm{F}\),\(\mathrm{O}\), o\(\mathrm{N})\).
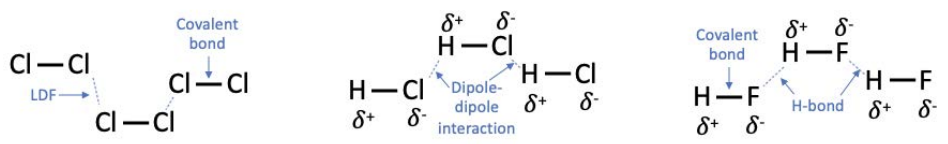
Generalmente, los LDF son más débiles que las interacciones dipolo-dipolo, y\(\mathrm{H}\) los enlaces son más fuertes de todos. Sin embargo, no hay forma de aplicar una clasificación única de la fuerza del FMI, ya que dependen de la geometría molecular específica, el volumen estérico (qué tan grande es la molécula), la disposición de los átomos, la polaridad y otros factores. Si una sustancia contiene moléculas con IMF más fuertes, requiere más energía para romper las moléculas, lo que generalmente significa que los materiales con IMF más fuertes tienen puntos de fusión más altos y puntos de ebullición más altos.
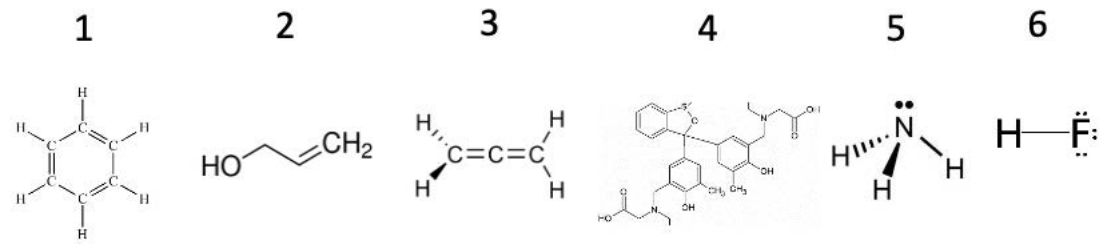
Ejemplo: ¿Va a\(\mathrm{H}\) -bond? Encierra en círculo las moléculas que forman enlaces de hidrógeno en solución.
- Contestar
-
1. Esta molécula tiene un anillo de carbonos, y cada carbono también está unido a un hidrógeno. No hay\(\mathrm{H}-\mathrm{F}\),\(\mathrm{H}-\mathrm{O}\), o\(\mathrm{H}-\mathrm{N}\) enlaces, por lo que esta molécula no forma\(\mathrm{H}\) -enlaces.
2. Aquí, la molécula se muestra en una notación típica de la química orgánica: cada vértice a lo largo de la línea que conecta\(\mathrm{HO}\) y\(\mathrm{CH}_2\) contiene un átomo de carbono + átomos de hidrógeno para completar el octeto, y las líneas que conectan los vértices representan enlaces. Escrito de otra manera, esta molécula es\(\mathrm{HO}-\mathrm{CH}_2-\mathrm{CH}=\mathrm{CH}_2\). Ninguno de los\(\mathrm{C}-\mathrm{H}\) enlaces participa en enlaces de hidrógeno, ¡pero los\(\mathrm{HO}\) grupos formarán\(\mathrm{H}\) -enlaces con los otros\(\mathrm{HO}\) grupos!
3. Similar a la primera, esta molécula sólo contiene enlaces entre\(\mathrm{C}\) y\(\mathrm{H}\) átomos. No formará\(\mathrm{H}\) bonos.
4. Están pasando muchas cosas con esta molécula. Los anillos aquí son el mismo tipo de estructura que el anillo en 1: puedes imaginarte rellenando un\(\mathrm{C}\) en cada vértice y luego poblando con\(\mathrm{H}\) para llenar los octetos. Esta molécula contiene\(\mathrm{N}\), pero todos los\(\mathrm{N}\) átomos están unidos solo a\(\mathrm{C}\): estos\(\mathrm{N}-\mathrm{C}\) grupos no formarán\(\mathrm{H}\) enlaces. Sin embargo, hay algunos\(\mathrm{OH}\) grupos: ¡estos formarán\(\mathrm{H}\) -enlaces con los\(\mathrm{OH}\) grupos en las moléculas vecinas!
5. Podrías reconocer esta molécula como amoníaco. Aquí, el\(\mathrm{N}\) átomo está unido directamente al hidrógeno. Estos grupos\(\mathrm{N}-\mathrm{H}\) finales formarán\(\mathrm{H}\) -enlaces.
6. Por último, esta molécula de ácido fluorhídrico es justa\(\mathrm{H}-\mathrm{F}\). Por lo tanto, formará\(\mathrm{H}\) -bonos.

