1.4: Polaridad de unión y fuerza de unión
- Page ID
- 72289
Linus Pauling introdujo el concepto de electronegatividad 1932 con el fin de explicar la estabilidad extra de moléculas con enlaces polares. [12] La electronegatividad de un átomo, representada por la letra griega χ, puede definirse como la tendencia de un átomo a atraer electrones hacia sí mismo en un enlace químico. En la escala Pauling, la diferencia de electronegatividad entre dos átomos A y B se definió en términos de las energías de disociación E d de los enlaces A-A, B-B y A-B:
\[\chi_{A} - \chi_{B} = \sqrt{E_{d}(AB) - [E_{d}(AA) + E_{d}(BB)]/2}\]
donde las energías se expresan en electrón-voltios.
Esta definición, si bien es directamente relevante para la fuerza de los enlaces químicos, requiere datos de entrada termoquímica de muchos compuestos, algunos de los cuales no estaban disponibles en ese momento. Mulliken [13] [14] y posteriormente Pearson [15] desarrollaron una escala de electronegatividades basada en el promedio de la afinidad electrónica y la energía de ionización de los átomos A y B libres, que correlacionaron con datos termoquímicos y la escala Pauling.
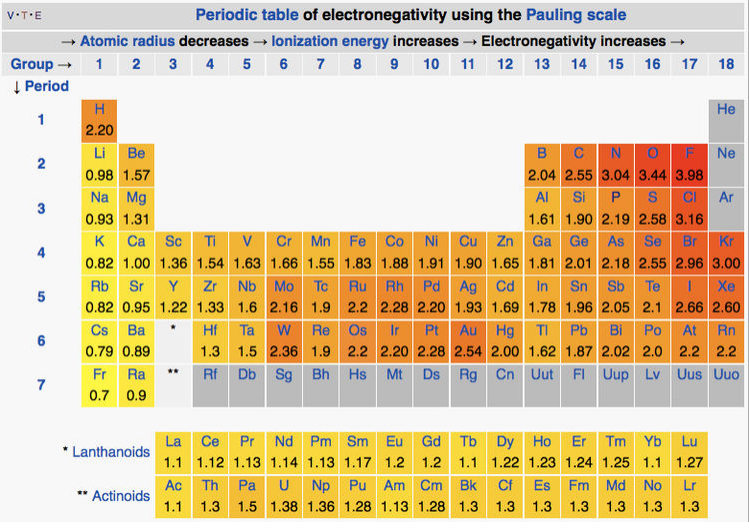
En la escala Pauling, los elementos menos electronegativos son los metales alcalinos (χ = 0.7-1.0) y los más electronegativos son oxígeno (3.5) y flúor (4.0) en la parte superior derecha de la tabla periódica. El carbono y el hidrógeno tienen electronegatividades intermedias (2.6 y 2.2 en la escala Pauling, respectivamente). La tendencia general (ver tabla a continuación) es que las electronegatividades aumentan subiendo y hacia la derecha en la tabla periódica. Hay algunas excepciones interesantes a este comportamiento, más notablemente dos islas de alta electronegatvidad en la parte inferior de la serie de transición, alcanzando un pico de tungsteno (χ = 2.4) y oro (χ = 2.5). El primero de ellos puede explicarse por la altísima energía de enlace metal-metal de elementos como Mo y W, que pueden utilizar los seis electrones de valencia en la unión, como discutiremos en el Capítulo 6. El segundo sin embargo ocurre con metales nobles más débilmente enlazados como Pt y Au, y es responsable de su baja posición en la serie de actividad, [16] así como sus extraordinarias propiedades como catalizadores.
Tabla de Electronegatividades Pauling
La polaridad de los enlaces está determinada por las diferencias de electronegatividad. Como pauta definimos los bonos como:
- iónico si Δχ > 2.0
- polar si 2.0 > Δχ > 0.5
- no polar si 0.5 > Δχ
La polaridad de los enlaces nos ayuda a comprender las fuerzas no covalentes entre las moléculas, como los enlaces de hidrógeno y las interacciones dipolo-dipolo. También nos ayuda a interpretar la reactividad de las moléculas. Por ejemplo, el enlace Si-H (χ Si = 1.8, χ H = 2.1) es más parecido al hidrido que el enlace C-H (χ C = 2.5, χ H = 2.1). Por lo tanto, los silanos reaccionan con los ácidos para hacer H 2, mientras que las fosfinas (χ P = 2.1) y los hidrocarburos no. De manera similar, las reacciones de sustitución electrófila ocurren más fácilmente en compuestos Si-H y P-H que en compuestos C-H.
También existe una correlación entre la fuerza de un enlace químico y la longitud del enlace, siendo los enlaces más largos más débiles debido a la superposición orbital más débil. Pauling introdujo una fórmula empírica que relaciona la longitud de la unión con la fuerza de unión. Para un par dado de átomos (por ejemplo, dos átomos de carbono):
\[D(n) = D(1) - 0.6 \log_{10}(n)\]
donde D (n) representa la longitud del enlace en Å y n es el orden de enlace. D (1) en este caso sería la longitud de un enlace sencillo C-C, que podemos obtener de la longitud promedio del enlace en alcanos (1.54 Å). Mediante esta fórmula podemos predecir que las longitudes de enlace en etileno (doble enlace C=C) y acetileno (triple enlace C=C) deben ser de 1.36 y 1.25 Å, respectivamente, que se acercan a los valores experimentales de 1.33 y 1.20 Å. En una forma relacionada, la fórmula Pauling se puede usar para calcular longitudes de enlace cuando la longitud de enlace simple D (1) no está disponible:
\[D(n) = D(m) -0.6 \log_{10}(n/m)\]
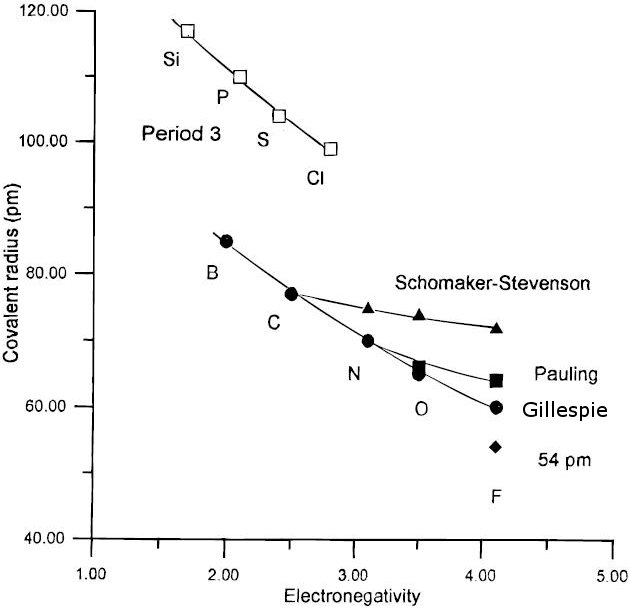
Aquí n y m representan dos órdenes de enlace diferentes entre los mismos tipos de átomos. Esto dice, por ejemplo, que la diferencia de longitud entre un triple y un doble enlace, D (2) -D (3), debe ser - 0.6 log 10 (2/3) = 0.11 Å. Algunas longitudes de enlace y energías de enlace son anómalas. Por ejemplo, la longitud del enlace F-F en F 2 es 1.43 Å, que es 0.15 Å más larga que el doble del radio covalente del átomo F (0.64 Å). El enlace F-F también es bastante débil (energía de disociación del enlace = 155 kJ/mol) en relación con el enlace Cl-Cl (242 kJ/mol). Al poner la longitud de enlace adicional en la fórmula de Pauling, calculamos que el orden de enlace en la molécula F 2 es solo 0.6, es decir, sustancialmente más débil que un enlace sencillo F-F. La razón física de esto es que el enlace F-F se “estira” por repulsión de los pares solitarios en los átomos F. Este hacinamiento es causado por el hecho de que el orbital del núcleo [He] 1s 2, así como los orbitales de valencia de los átomos de flúor, son contraídos por la alta carga nuclear. El átomo de Cl 2, con su núcleo mayor [Ne] (1s 2 2s 2 2p 6), en contraste, tiene una longitud de enlace sencillo “normal” (1.98 Å) que es el doble del radio covalente del átomo de Cl (0.99 Å). Un efecto similar de repulsión de pares solitarios explica los enlaces simples N-N y O-O anómalamente largos y débiles en la hidrazina (H 2 N-NH 2) y el peróxido de hidrógeno (HO-OH), que son moléculas altamente reactivas.
Los papeles importantes de las diferencias de electronegatividad y la repulsión de pares solitarios son evidentes al comparar tendencias en las fortalezas de los enlaces. La siguiente tabla muestra el promedio de entalpías de enlace simple de elementos de bloque p con H y F. H hace enlaces más fuertes con elementos de segunda fila (C, N, O, F) que con elementos de tercera fila (Si, P, S, Cl) porque los electrones de valencia 2p están más cerca del núcleo y así hacen enlaces más fuertes que los electrones en orbitales 3p. Los enlaces a H también siguen la tendencia esperada de aumentar la fuerza de unión con el aumento de la diferencia de electronegatividad. Sin embargo, los enlaces entre los elementos de la segunda fila (C, N, O, F) y F son anómalamente débiles debido a la repulsión de pares solitarios. Por esta razón, el enlace Si-F es sustancialmente más fuerte que el enlace C-F, mientras que el enlace C-H es mucho más fuerte que el enlace Si-H. El fuerte enlace Si-F es la razón por la que HF graba vidrio (para producir el anión SiF 6 2 -), y el fuerte enlace C-H es un factor importante en la estabilidad de hidrocarburos y otras moléculas orgánicas.
| C-H 413 | N-H 391 | O-H 483 | H-F 567 |
| Si-H 323 | P-H 322 | S-H 339 | H-Cl 431 |
| C-F 485 | N-F 272 | O-F 190 | F-F 155 |
| Si-F 565 | P-F 490 | S-F 327 | Cl-F 253 |
El enlace anómalo débil en F 2 es responsable de la alta electronegatividad del flúor, así como de la legendaria reactividad del gas flúor elemental, que reacciona explosivamente con hidrógeno y metales en polvo. Debido a la inestabilidad del flúor elemental y la naturaleza polar de sus enlaces con más elementos electropositivos, los compuestos de flúor tienden a ser muy estables. Por ejemplo, los gases nobles Xe y Kr reaccionan con flúor para elaborar compuestos covalentes, mientras que otros halógenos no reaccionan. Los compuestos fluorocarbonados contienen fuertes enlaces C-F y tienen una alta estabilidad térmica y química. Los perfluorocarbonos como el Teflón (poli (tetrafluoroetileno), - (CF 2 CF 2) n-, PTFE) también son altamente hidrófobos. La extraordinaria hidrofobicidad de los perfluorocarbonos surge del hecho de que los grupos -CF 2 - y -CF 3 son “más gordos” que los grupos -CH 2 - y -CH 3; disolverlos en agua es por lo tanto más perjudicial para la red de enlaces de hidrógeno que disolver un hidrocarburo. [21]



