2.9: Construyendo los MOs de Moléculas Más Complejas- NH₃, Ps4
- Page ID
- 72054
Diagrama MO para NH 3
Ahora podemos intentar el diagrama MO para NH 3, partiendo del resultado que obtuvimos con H 3 + triangular.
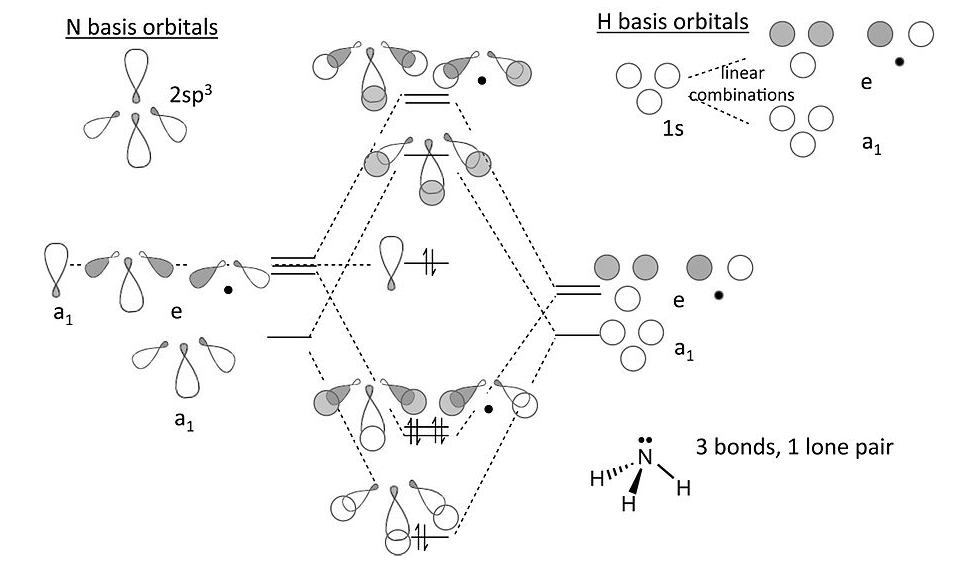
Notas sobre el diagrama MO para amoníaco:
- Visto desde el extremo, un orbital p o un orbital híbrido sp x se parece a un orbital s-orbital. Por lo tanto, podemos usar las soluciones que desarrollamos con orbitales s (para H 3 +) para establecer las combinaciones de unión σ y antiunión de orbitales de nitrógeno sp 3 con los orbitales H 1s.
- Ahora construimos los orbitales híbridos sp 3 del átomo de nitrógeno y los orientamos de manera que uno esté “arriba” y los otros tres formen la base triangular del tetraedro. Estos tres últimos, por analogía con el ion H 3 +, se transforman como un orbital totalmente simétrico (“a 1”) y un par de e-simetría. El orbital híbrido en la parte superior del tetraedro también tiene una simetría 1.
- Los tres orbitales de hidrógeno 1s también hacen una combinación de uno a 1 y uno (doblemente degenerada) e. Hacemos combinaciones de unión y antiadhesión con los orbitales de nitrógeno de la misma simetría. El resto de un 1 orbital en N no es de unión. Las líneas punteadas muestran la correlación entre los orbitales de base de la simetría a 1 y e y los orbitales moleculares
- El resultado en la molécula NH 3 de 8 electrones es de tres enlaces N-H y un par solitario localizado en N, lo mismo que la imagen del enlace de valencia (¡pero mucho más trabajo!).
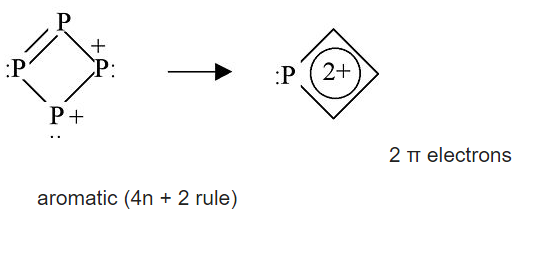
Molécula P 4 e ion P 4 2 +:
Por analogía con NH 3 podemos construir la imagen MO para un vértice del tetraedro P4, y luego multiplicar el resultado por 4 para obtener la imagen de unión para la molécula. Una diferencia importante es que hay relativamente poca hibridación s-p en P 4, por lo que los orbitales de pares solitarios tienen más carácter s y son más bajos en energía que los orbitales de unión, que son principalmente pσ.

Quita 2 electrones para hacer P 4 2 +
El MO ocupado más alto es un orbital de unión → romper un enlace, 5 enlaces a la izquierda
La forma cuadrada alivia la tensión del anillo, (60° → 90°)