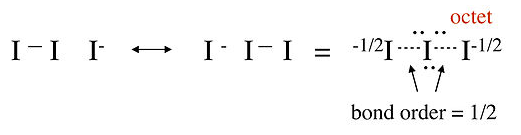2.10: Homología de orbitales σ y π en diagramas MO
- Page ID
- 72066
La molécula de ozono (y las moléculas 18e relacionadas que contienen tres átomos que no son H, como NO 2 - y el anión alilo [CH 2 -CH-CH 2] -) es un ejemplo de enlace p de 4 electrones en 3 centros. Nuestro tratamiento MO del ozono es totalmente análogo al anión H 3 de 4 electrones. Mapeamos esa solución en esta de la siguiente manera:
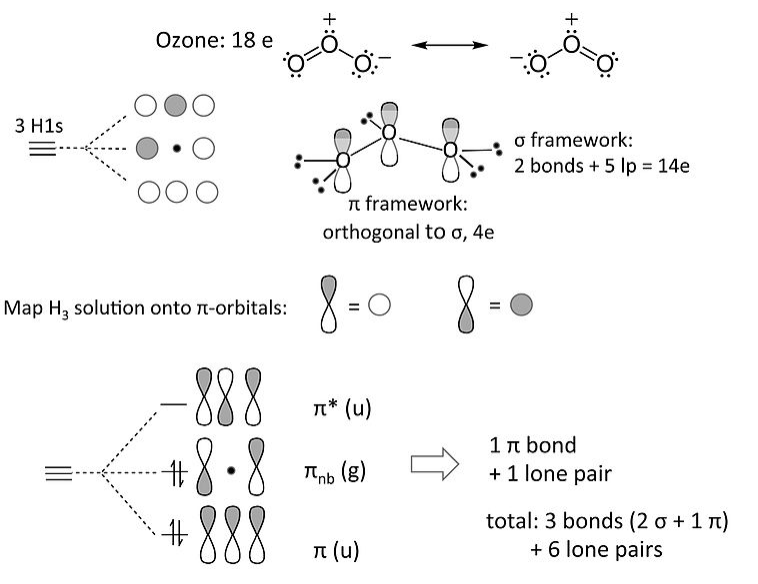
El orbital π-orbital no enlazante tiene un nodo en el átomo central de O. Esto significa que el par de electrones no enlazantes en el sistema π es compartido por los dos átomos O terminales, es decir, que la carga formal es compartida por esos átomos. Esto es consistente con la estructura de resonancia octeto del ozono.
Este truco de mapear la solución para un conjunto de orbitales s sobre un problema de enlace π es un ejemplo simple de un principio más amplio llamado analogía isolobular. Esta idea, desarrollada ampliamente por Roald Hoffmann en la Universidad de Cornell, se ha utilizado para comprender la unión y reactividad en compuestos organometálicos. [5] En la analogía isolobular, los principios de simetría (como se ilustra anteriormente en la analogía entre H 3 - y ozono) se utilizan para construir diagramas MO de moléculas complejas que contienen orbitales de frontera d a partir de fragmentos moleculares más simples.
|
Las ideas del profesor Roald Hoffmann sobre la simetría orbital han ayudado a explicar la unión y reactividad de las moléculas orgánicas y organometálicas, así como las estructuras y propiedades de los sólidos extendidos. |
El ion triyoduro. Un caso análogo (y aparentemente más complicado) de enlace de 4 electrones de 3 centros es I 3 -. Cada átomo I tiene 4 orbitales de valencia (5s, 5p x, 5p y, 5p z), haciendo un total de 12 orbitales fronterizos, y el anión I 3 tiene 22 electrones.
Podemos simplificar el problema recordando dos tendencias periódicas:
- La división orbital s-p es grande, relativa a la energía del enlace, después de la segunda fila de la tabla periódica. Así, la órbita 5s es baja en energía y demasiado contraída para hacer enlaces con sus vecinos.
- π-superposición de orbitales 5p es muy débil, por lo que los orbitales 5p x y 5p y también serán no vinculantes.
Esto deja solo los tres orbitales 5p z para hacer combinaciones de unión/no unión/antiadhesión. Nuevamente, el problema es totalmente análogo al ozono o H 3 -.
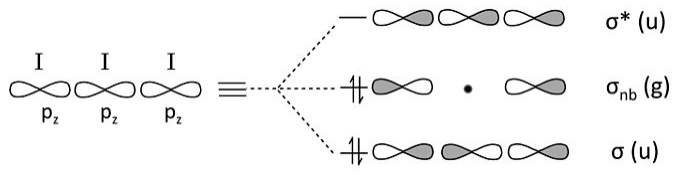
Contando orbitales obtenemos 9 pares solitarios de los orbitales 5s, 5p x y 5p y no enlazantes, así como un enlace y un par solitario de las combinaciones orbitales 5p z anteriores. El total de 10 pares no enlazantes y un enlace representa los 22 electrones en el ion. El par 5p z no enlazante se localiza en los átomos I terminales, dando a cada uno una carga formal -1/2. Esta descripción MO es totalmente consistente con la imagen de resonancia sin enlace octeto de I 3 -que desarrollamos en el Capítulo 1.