3.5: Pares Lewis Frustrados
- Page ID
- 72099
Un par de Lewis frustrado (FLP) es un compuesto o mezcla que contiene un ácido de Lewis y una base de Lewis que, debido a un impedimento estérico, no pueden combinarse para formar un aducto clásico. [8] Se han ideado muchos tipos de FLP y su reactividad hacia otras moléculas se ha desarrollado ampliamente. [9] [10]
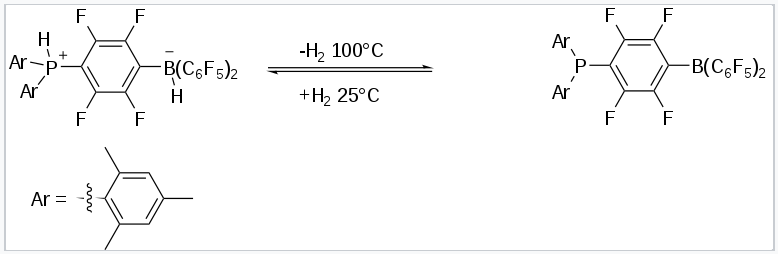
El aducto de hidrógeno del FLP original, una sal de fosfonio-borato, se puede preparar combinando un fosfinoborano con puente de fenileno y dihidrógeno. La sal, que es incolora, es estable en presencia de aire y humedad. Libera H 2 molecular cuando se calienta por encima de 100 °C, esta reactividad es notable considerando la fuerza del enlace H-H, 432 kJ/mol.
|
Absorción y liberación de hidrógeno de FLP |
El descubrimiento de que algunos FLP pueden dividir H 2 [11] desencadenó el rápido crecimiento de la investigación en FLP's. Debido a su reactividad “no apagada”, dichos sistemas son reactivos hacia sustratos que pueden sufrir heterólisis. Por ejemplo, muchos FLP dividen la molécula de hidrógeno. Esta reactividad sugiere que los FLP's pueden ser útiles para reacciones de hidrogenación. Ahora se ha desarrollado un rango considerable de reacciones catalíticas homogéneas y heterogéneas utilizando FLP's.
Las mezclas de ácidos y bases de Lewis con impedimento estérico también pueden actuar como FLP. Una estrategia exitosa es mezclar triarilfosfinasestéricamente impedidas con triarilboranos. Moléculas pequeñas tales como CO 2 y etileno pueden formar entonces un puente entre la base de Lewis de fosfina y el ácido borano de Lewis, p.
\(\ce{P(t-Bu)3 + B(C6F5)3 + CO2 -> (t-Bu)3P^{+}C(O)OB^{-}(C6F5)3}\)
\(\ce{PCy3 + B(C6F5)3 + C2H4 -> Cy3P^{+}CH2CH2B^{-}(C6F5)3}\)
Debido a que los FLP se comportan al mismo tiempo como nucleófilos y electrófilos, pueden efectuar la apertura del anillo de éteres cíclicos como THF, 2,5-dihidrofurano, cumarano y dioxano. [12]