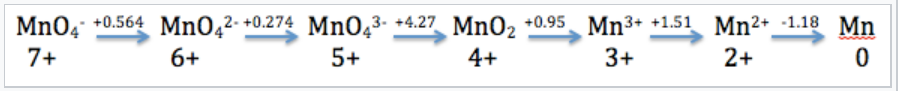4.4: Diagramas Latimer y Frost
- Page ID
- 72203
Además de los diagramas de Pourbaix, existen otros dos tipos de diagramas de estabilidad redox conocidos como diagramas Latimer y Frost. Cada uno de estos diagramas contiene información similar, pero una representación puede ser más útil en una situación dada que las otras.
Los diagramas Latimer y Frost ayudan a predecir la estabilidad en relación con estados de oxidación más altos y menores, generalmente a un pH fijo. Los diagramas de Pourbaix ayudan a comprender los equilibrios dependientes del pH, que a menudo se acoplan a equilibrios de solubilidad y corrosión (de los que se hablará más adelante).
|
Los nódulos de manganeso en el fondo marino contienen Mn en los estados de oxidación 2+, 3+ y 4+. |
Diagramas Latimer:
Los diagramas Latimer son la forma más antigua y compacta de representar equilibrios electroquímicos para sustancias que tienen múltiples estados de oxidación. Los valores de potencial electroquímico se escriben para reacciones redox sucesivas (de mayor a menor estado de oxidación), típicamente bajo condiciones estándar en ácido fuerte ([H +] = 1 M, pH 0) o base fuerte ([OH -] = 1 M, pH 14). Los estados de oxidación de sustancias sucesivas en un diagrama Latimer pueden diferir en uno o más electrones. Los estados de oxidación para el elemento sometido a redox se determinan típicamente por la diferencia; asignamos a los átomos de oxígeno un estado de oxidación de -2 y a los átomos de hidrógeno un estado de oxidación de +1.
Ejemplo:
Mn en ácido
|
El diagrama Latimer para Mn ilustra sus potenciales de reducción estándar (en ácido 1 M) en estados de oxidación de +7 a 0. |
El diagrama Latimer comprime en notación taquigráfica todos los potenciales estándar para las reacciones redox del elemento Mn. Por ejemplo, la entrada que conecta Mn 2+ y Mn da el potencial para la reacción de media celda:
\(\ce{Mn^{2+}_{(aq)} + 2e^{-} ->Mn_{(s)}}\)E 1/2° = -1.18V
y la entrada que conecta Mn 4+ y Mn 3+ representa la reacción:
\(\ce{MnO2_{(s)} + 4H^{+}_{(aq)} + e^{-} -> Mn^{3+}_{(aq)} + 2H2O_{(l)}}\), :E 1/2° = +0.95V
También podemos calcular los valores para las reacciones de múltiples electrones agregando primero los valores ΔG° (=-NFe°) y luego dividiendo por el número total de electrones
Por ejemplo, para la reducción de 5 electrones de MnO 4 - a Mn 2+, escribimos
\[E^{o} =\frac{1(0.564) + 1(0.274) + 1(4.27) + 1(0.95) + 1(1.51)}{5} = + 1.51V\]
y para la reducción de tres electrones de MnO 4 - (aq) a MnO 2 (s),
\[E^{o} = \frac{1(0.564) + 1(0.274) + 1(4.27)}{3} = +1.70V\]
Recuerde dividir por el número de electrones involucrados en el cambio del número de oxidación (5 y 3 para las ecuaciones anteriores).
Estados de oxidación termodinámicamente estables e inestables
Una especie inestable en un diagrama de Latimer tendrá un potencial estándar inferior a la izquierda que a la derecha.
Ejemplo:
\ (\ ce {2MnO4^ {3-} -> MnO2 + MnO4^ {2-}}\) la especie MnO 4 3- es inestable
\(E^{o}= +4.27-0.274 = 3.997V\)(desproporción espontánea)
¿Qué especies de Mn son inestables con respecto a la desproporción?
MnO 4 3- 5+ → 6+,4+
Mn 3+ 3+ → 4+,2+
Por lo que las especies estables son: MnO 4 -, MnO 4 2-, MnO 2, Mn 2+ y Mn 0.
Pero MnO 4 2- también es inestable - ¿por qué?
\(\ce{MnO4^{2-} -> MnO2}\)
\(\ce{2MnO4^{2-}->2MnO4^{-} + MnO2}\)E° = 2.272 - 0.564 = +1.708 V
Moral: Se deben considerar todas las posibles reacciones de desproporción para determinar la estabilidad (esto suele ser más conveniente con un diagrama de Frost).
Nota
Los iones termodinámicamente inestables pueden ser bastante estables cinéticamente. Por ejemplo, la mayoría de las moléculas que contienen N (NO 2, NO, N 2 H 4) son inestables en relación con los elementos (O 2, N 2, H 2), pero siguen siendo cinéticamente bastante estables.
Diagramas Frost:
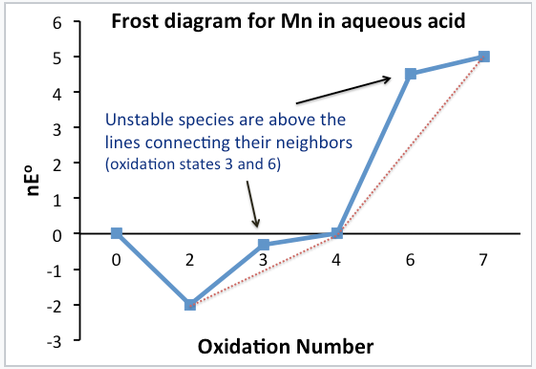
En un diagrama de Frost, se grafica ΔG°⁄F (= Ne°) vs. número de oxidación. Al estado de oxidación cero se le asigna un valor de nE° de cero. [2]
Los estados de oxidación estables e inestables se pueden identificar fácilmente en la parcela. Los compuestos inestables son más altos en la parcela que la línea que conecta a sus vecinos. Tenga en cuenta que esto es simplemente una representación gráfica de lo que hicimos con el diagrama de Latimer para determinar qué estados de oxidación fueron estables e inestables.
El potencial estándar para cualquier reacción electroquímica viene dado por la pendiente de la línea que conecta las dos especies en un diagrama de Frost. Por ejemplo, la línea que conecta Mn 3+ y MnO 2 en el diagrama Frost tiene una pendiente de +0.95, el potencial estándar de reducción de MnO 2 a Mn 3+. Este es el número que está escrito encima de la flecha en el diagrama de Latimer para Mn. Los potenciales multielectrones se pueden calcular fácilmente conectando los puntos en un diagrama de Frost.
|
|
Un diagrama de Frost:
- Contiene la misma información que en un diagrama Latimer, pero muestra gráficamente la estabilidad y el poder oxidante.
- Las especies más bajas en el diagrama son las más estables (Mn 2+, MnO 2)
- Las especies más altas en el diagrama son los oxidantes más fuertes (MnO 4 -)