4.6: Diagramas de Pourbaix
- Page ID
- 72192
Los diagramas de Pourbaix representan la estabilidad electroquímica para diferentes estados redox de un elemento en función del pH. [3] Como se señaló anteriormente, estos diagramas son esencialmente diagramas de fase que mapean las condiciones de potencial y pH (más típicamente en soluciones acuosas) donde diferentes especies redox son estables. Vimos un ejemplo simple de dicho diagrama en la sección 4.2 para H 2 O. Típicamente, las reacciones redox de agua se trazan como líneas punteadas en estos diagramas más complicados para otros elementos.
Las líneas en los diagramas de Pourbaix representan reacciones redox y ácido-base, y son las partes del diagrama donde dos especies pueden existir en equilibrio. Por ejemplo, en el diagrama Pourbaix para Fe a continuación, la línea horizontal entre las regiones Fe 3+ y Fe 2+ representa la reacción\(\ce{Fe^{3+}_{(aq)} + e^{-} = Fe^{2+}_{(aq)}}\), que tiene un potencial estándar de +0.77 V. Si bien podríamos usar potenciales estándar para todas estas líneas, en la práctica los diagramas de Pourbaix suelen ser trazados para concentraciones de iones más bajas (a menudo 1 mM) que son más relevantes para la corrosión y los experimentos electroquímicos.
Ejemplo: Diagrama de hierro Pourbaix
Las áreas en el diagrama Pourbaix marcan regiones donde una sola especie (Fe 2+ (aq), Fe 3 O 4 (s), etc.) es estable. Las especies más estables tienden a ocupar áreas más grandes.
Las líneas marcan lugares donde existen dos especies en equilibrio.
- Las reacciones redox puras son líneas horizontales, estas reacciones no dependen del pH
- Las reacciones ácido-base puras son líneas verticales, estas no dependen del potencial
- Las reacciones que son tanto ácido-base como redox tienen una pendiente de -0.0592 V/pH x # H + ⁄# e -)
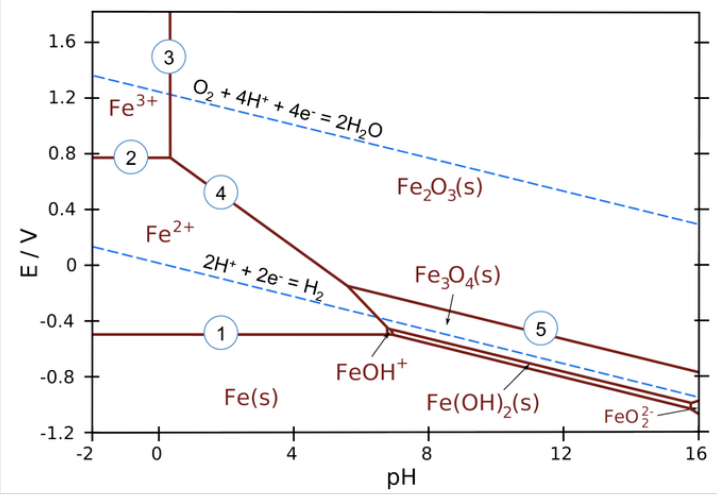
Ejemplos de equilibrios en el diagrama de hierro Pourbaix (numerados en la parcela):
1. \(\ce{Fe^{2+} + 2e^{-} -> Fe_{(s)}}\)(reacción redox pura - sin dependencia del pH)
2. \(\ce{Fe^{3+} + e^{-} -> Fe^{2+}}\)(reacción redox pura - sin dependencia del pH)
3. \(\ce{2Fe^{3+} + 3H2O -> Fe2O3_{(s)} + 6H^{+}}\)(ácido-base puro, sin redox)
4. \(\ce{2Fe^{2+} + 3H2O -> Fe2O3_{(s)} + 6H^{+} + 2e^{-}}\)(pendiente = -59.2 x 6/2 = -178 mV/pH)
5. \(\ce{2Fe3O4_{(s)} + H2O -> 2H^{+} + 2e^{-}}\)(pendiente = -59.2 x 2/2 = -59.2 mV/pH)
Las líneas redox de agua tienen especial importancia en un diagrama de Pourbaix para un elemento como el hierro. Recordemos que el agua líquida es estable sólo en la región entre las líneas punteadas. Por debajo de la línea H 2, el agua es inestable en relación con el gas hidrógeno, y por encima de la línea O 2, el agua es inestable con respecto al oxígeno. Para los metales activos como el Fe, la región donde el elemento puro es estable está típicamente por debajo de la línea H 2. Esto significa que el hierro metálico es inestable en contacto con el agua, experimentando reacciones:
\(\ce{Fe_{(s)} + 2H^{+} -> Fe^{2+}_{(aq)} + H2}\)(en ácido)
\(\ce{fe_{(s)} + 2H2O -> Fe(OH)2_{(s)} + H2}\)(en base)
El hierro (y la mayoría de los otros metales) también son termodinámicamente inestables en agua saturada de aire, donde el potencial de la solución está cerca de la línea O 2 en el diagrama de Pourbaix. Aquí las reacciones espontáneas son:
\(\ce{4Fe_{(s)} + 3O2 + 12H^{+} -> 4Fe^{3+} + 6H2O}\)(en ácido)
\ (\ ce {4Fe_ {(s)} + 3O2 -> 2Fe2O3_ {(s)} (en base)
Corrosión y pasivación. Ciertamente suena mal para nuestro amigo Fe: inestable en el agua, sin importar el pH o el potencial. Dado el tiempo suficiente, todo se convertirá en óxido. Pero el hierro (y otros metales activos) puede corroerse, o puede estabilizarse contra la corrosión, dependiendo de las condiciones. Porque nuestra civilización depende del uso de metales activos como Fe, Al, Zn, Ti, Cr... para prácticamente todo, es importante entender esto, y podemos hacerlo haciendo referencia al diagrama de Pourbaix.
La corrosión del hierro (y otros metales activos como Al) es efectivamente rápida en partes del diagrama de Pourbaix donde el elemento se oxida a un producto iónico soluble como Fe 3+ (aq) o Al 3+ (aq). Sin embargo, sólidos como el Fe 2 O 3, y especialmente el Al 2 O 3, forman un recubrimiento protector sobre el metal que impide en gran medida la reacción de corrosión. Este fenómeno se llama pasivación.
Dibuja una línea vertical a través del diagrama de hierro Pourbaix al pH del agua del grifo (aproximadamente 6) y descubrirás algo interesante: a pH ligeramente ácido, el hierro es bastante inestable con respecto a la corrosión por la reacción:
\[\ce{Fe_{(s)} + 2H^{+} -> Fe^{2+}_{(aq)} + H2}\]
pero sólo en agua que contiene relativamente poco oxígeno, es decir, en soluciones donde el potencial está cerca de la línea H 2. Saturar el agua con aire u oxígeno mueve el sistema más cerca de la línea O 2, donde la especie más estable es Fe 2 O 3 y la reacción de corrosión es:
\[\ce{4Fe_{(s)} + 3O2 -> 2Fe2O3_{(s)}}\]
Esta reacción de oxidación es órdenes de magnitud más lenta debido a que el óxido que se forma pasiva la superficie. Por lo tanto, el hierro se corroe mucho más lentamente en soluciones oxigenadas.
Más generalmente, el hierro (y otros metales activos) se pasivan cada vez que se oxidan para producir un producto sólido, y se corroen cuando el producto es iónico y soluble. Este comportamiento se puede resumir en el diagrama de Pourbaix codificado por colores a continuación. Las regiones roja y verde representan condiciones bajo las cuales la oxidación del hierro produce productos solubles e insolubles, respectivamente.
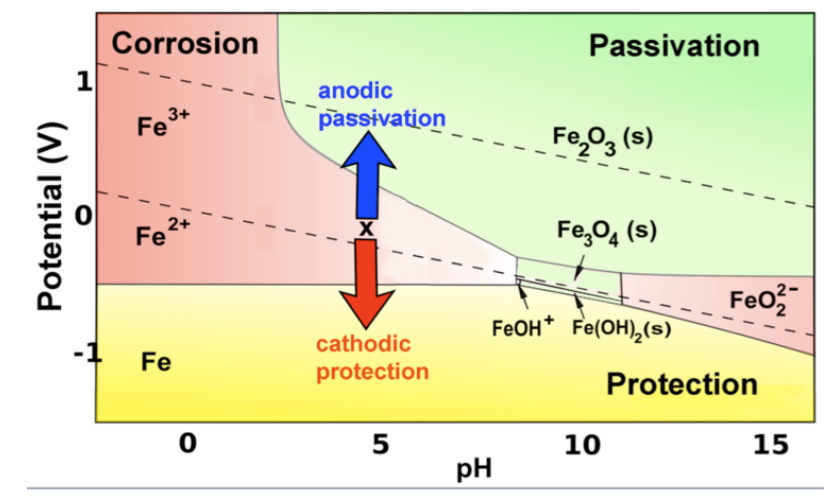
En la parte amarilla del diagrama, un metal activo como el hierro puede ser protegido por un segundo mecanismo, que es polarizarlo para que su potencial esté por debajo del potencial de oxidación del metal. Esta estrategia de protección catódica se lleva a cabo con mayor frecuencia conectando un metal más activo como Mg o Zn al objeto de hierro o acero (por ejemplo, el casco de un barco, o un gasoducto subterráneo) que se está protegiendo. El metal activo (que debe ser mayor que el Fe en la serie de actividad) también está en contacto con la solución y se corroe lentamente, por lo que eventualmente debe ser reemplazado. En algunos casos, se usa una fuente de alimentación de batería o CC, cuyo ánodo oxida el agua a oxígeno en la solución, para aplicar un sesgo negativo.
|
Los parches blancos visibles en el casco del barco son ánodos de sacrificio de bloques de zinc. |
Otro modo común de corrosión del hierro y el acero al carbono es la aireación diferencial. En este caso, parte del objeto de hierro -por ejemplo, la base de un puente, o el taladro en una plataforma petrolera- se encuentra bajo el agua o en un ambiente anóxico como el barro o el suelo. El potencial de la solución es cercano a la línea H 2 en el diagrama de Pourbaix, donde el Fe puede corroerse a Fe 2+ (aq). Otra parte del objeto de hierro está en el aire, o cerca de la superficie donde el agua está bien oxigenada. En esa superficie el oxígeno se puede reducir a agua, O 2 + 4H + + 4e - = 2 H 2 O. El objeto de hierro conductor completa el circuito, transportando electrones desde el ánodo (donde se oxida Fe) hasta el cátodo (donde O 2 se reduce). La corrosión por aireación diferencial puede ser rápida debido a que se producen iones solubles, y la reacción tiene una fuerza impulsora de más de 1 V. El hierro o acero al carbono que es sometido a frecuentes meteorización, como el puente de hierro fundido y la farola que se muestran a continuación, se corroe en la superficie por aireación diferencial.
|
Puente y farola de hierro fundido oxidado, North Ayrshire, Escocia |
La aireación diferencial está involucrada en la formación de un anillo de óxido alrededor de áreas húmedas de hierro fundido, por ejemplo, una sartén de hierro que queda parcialmente sumergida en agua durante un día o más. (Es posible que hayas visto este mecanismo de corrosión en acción cuando no llegaste a los platos sucios de inmediato). Bajo el agua, el Fe se oxida a Fe 2+ soluble, y en la línea de agua O 2 se reduce a H 2 O. A medida que los iones Fe 2+ se difunden hacia la superficie del agua, encuentran moléculas de oxígeno y se oxidan a Fe 3+. Sin embargo Fe 3+ es insoluble a pH neutro y se deposita como óxido, típicamente justo debajo de la línea de agua, formando el anillo de óxido.




