5.4: Serie Espectroquímica
- Page ID
- 72309
Ligandos de campo fuertes y débiles. La serie espectroquímica clasifica a los ligandos según la diferencia de energía Δ O entre los orbitales t 2g y e g en sus complejos octaédricos. Esta diferencia de energía se mide en la transición espectral entre estos niveles, que a menudo se encuentra en la parte visible del espectro y es responsable de los colores de los complejos con orbitales d parcialmente llenos. Los ligandos que producen una división grande se denominan ligandos de campo fuerte, y los que producen una división pequeña se denominan ligandos de campo débil.

Una serie espectroquímica abreviada es:
Campo débil I - < Br - < Cl - < NO 3 - < F - < OH - < H 2 O < Piridina < NH 3 < NO 2 - < CN - < CO Campo fuerte
Superposición orbital
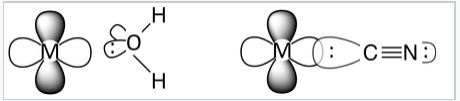
Refiriéndose al diagrama orbital molecular anterior, vemos que la división entre los niveles de electrones d refleja la interacción antiunión entre los orbitales metálicos e g y los ligandos. Por lo tanto, esperamos que la intensidad del campo del ligando se correlacione con la superposición orbital metal-ligando. Por lo tanto, se espera que los ligandos que se unen a través de átomos muy electronegativos tales como O y halógenos sean de campo débil, y los ligandos que se unen a través de C o P son típicamente de campo fuerte. Los ligandos que se unen a través de N tienen una fuerza intermedia. Otra forma de poner esto es que las bases duras tienden a ser ligandos de campo débiles y las bases blandas son ligandos de campo fuertes.
|
El agua es un ligando de campo débil. El átomo de O electronegativo es fuertemente atrayente de electrones, por lo que existe una pobre superposición orbital entre el par de electrones en O y un d-orbital metálico. El átomo de C más electropositivo en el ligando de campo fuerte CN, permite una mejor superposición orbital y distribución del par de electrones. Tenga en cuenta que CN - normalmente coordina los iones metálicos a través del átomo de C en lugar del átomo de N. |
|
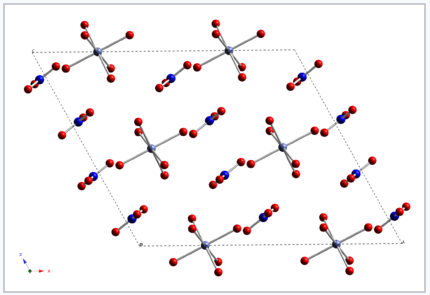
Los complejos de cobalto (II) tienen diferentes colores dependiendo de la naturaleza del ligando. En los cristales del compuesto rojo cobalto (II) nitrato dihidratado, cada ion cobalto está coordinado por seis moléculas de agua. Los cationes [Co (H 2 O) 6] 2+ y NO 3 - aniones cristalizan para hacer una sal. Cuando el complejo se disuelve en agua, el Co (II) conserva su capa de coordinación de seis moléculas de agua y la solución tiene el mismo color rojo que el cristal. |
Unidades de energía
La energía se puede calcular de varias maneras y es útil tratar de relacionar la energía de división Δ O con cantidades más familiares como las energías de enlace.
\[E=h\nu=h\frac{c}{\lambda} = hc{\tilde{\nu}}\]
Aquí ν es la frecuencia de la radiación electromagnética, h es la constante de Planck (6.626x10-34 J*s), y c es la velocidad de la luz. \({\tilde{\nu}}\)se llama el “número de onda” y es el inverso de la longitud de onda, generalmente medido en cm -1. Las brechas de energía a menudo son expresadas por espectroscopistas en términos de números de onda.
Por ejemplo, un fotón rojo tiene una longitud de onda de aproximadamente 620 nm y un número de onda de aproximadamente 16,000 cm -1. En otras unidades de energía, el mismo fotón rojo tiene una energía de 2.0 eV (1 eV = 1240 nm) o 193 kJ/mol (1 eV = 96.5 kJ/mol). Si comparamos esto con la energía de disociación de un enlace sencillo carbono-carbono (350 kJ/mol), vemos que el enlace C-C tiene aproximadamente el doble de energía que un fotón rojo. Se necesitaría un fotón ultravioleta (E > 350 kJ/mol = 3.6 eV = 345 nm = 29,000cm -1) para romper un enlace C-C.
Veremos que Δ O varía ampliamente para los complejos de metales de transición, desde longitudes de onda de infrarrojo cercano a ultravioleta. Así, la diferencia de energía entre los orbitales t 2g y e g puede variar entre la energía de un enlace covalente bastante débil a uno bastante fuerte.
Δ O depende tanto del metal como del ligando. Podemos aprender algo sobre las tendencias en Δ O comparando una serie de complejos metálicos d 6
| Complejo | Δ O (cm -1) |
|---|---|
| [Co (H 2 O) 6] 2+ | 9,300 |
| [Co (H 2 O) 6] 3+ | 18,200 |
| [Co (CN) 6] 3- | 33,500 |
| [Rh (H 2 O) 6] 3+ | 27,000 |
| [Rh (CN) 6] 3- | 45,500 |
Tendencias importantes en Δ O:
- Los complejos Co 3+ tienen mayor Δ O que los complejos de Co 2+ con el mismo ligando. Esto refleja la naturaleza electrostática de la división del campo cristalino.
- Los complejos Rh 3+ tienen mayor Δ O que los complejos de Co 3+. En general, los elementos de la segunda y tercera serie de transición (los elementos 4d y 5d) tienen una división mayor que los de la serie 3d.
Para un metal dado en un estado de oxidación (por ejemplo, Co 3+), la tendencia en Δ O sigue la serie espectroquímica. Así pues, Δ O es mayor para [Co (CN) 6] 3-, que contiene el ligando CN de campo fuerte, que para [Co (H 2 O) 6] 3+ con el ligando de campo débil H 2 O.
Los elementos 4d y 5d son similares en su tamaño y su química. Al comparar los valores de Δ O para complejos en las series 3d, 4d y 5d (por ejemplo, comparando elementos en las tríadas Co, Rh, Ir o Fe, Ru, Os), siempre encontramos 3d << 4d 5d. Esta tendencia refleja la extensión espacial de los orbitales d y, por lo tanto, su superposición con orbitales ligandos. Los orbitales 3d son más pequeños, y son menos efectivos en la unión que los 4d o 5d. Los orbitales 4d y 5d son similares entre sí debido a la contracción de los lantánidos. Al inicio de la serie 5d (entre 56 Ba y 72 Hf) se encuentran los catorce elementos lantánidos (57 La - 71 Lu).
Aunque los orbitales de valencia de los elementos 5d se encuentran en una capa cuántica principal superior a la de los elementos 4d, la adición de 14 protones al núcleo al cruzar la serie de lantánidos contrae los tamaños de los orbitales atómicos. El resultado importante es que los orbitales de valencia de los elementos 4d y 5d tienen tamaños similares y así los elementos se asemejan entre sí en su química mucho más de lo que se parecen a sus primos en la serie 3d. Por ejemplo, la química del Ru es muy similar a la de Os, como se ilustra a continuación, pero bastante diferente a la del Fe.
|
Tanto Os como Ru forman tetróxidos moleculares volátiles MO 4. El OsO 4 se utiliza en reacciones de epoxidación y como tinción en microscopía electrónica. En contraste, el óxido binario más alto de hierro es Fe 2 O 3. |
Colores de complejos de metales de transición
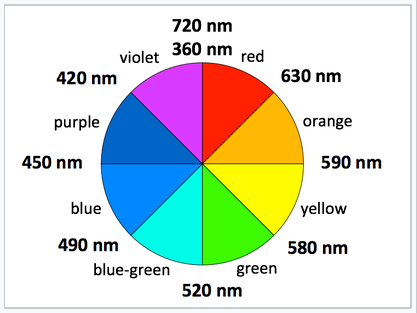
Una manera simple y cualitativa de ver la energía relativa de división del campo cristalino, Δ O, es observar el color de un complejo de metal de transición. Cuanto mayor sea la energía del fotón absorbido, mayor será la brecha de energía. Sin embargo, el color que absorbe un complejo es complementario al color que aparece (es decir, el color de la luz que refleja), que es opuesto al color absorbido en la rueda de colores.
|
Los colores complementarios están a través de la rueda de colores entre sí |
Ejemplos: (todos los complejos d 7 Co 2+)
[Co (H 2 O) 6] 2+ luce púrpura en sus sales y en solución concentrada porque absorbe en el rango verde.
[Co (NH 3) 6] 2+ es de color pajizo porque absorbe en el rango azul.
[Co (CN) 6] 4-, se ve rojo, absorbe en la parte violeta y ultravioleta del espectro. Esto concuerda con la idea de que CN - es un ligando de campo más fuerte que el NH 3, debido a que la energía de un fotón UV es mayor que la de un fotón rojo-naranja.
Este método es aplicable a la mayoría de los complejos de metales de transición, ya que la mayoría de ellos absorben en algún lugar del rango visible (400-700 nm = 25,000 a 14,300 cm -1), o tienen transiciones UV que colan hacia lo visible, haciéndolos parecer amarillos; sin embargo existen complejos como [Rh (CN) 6] 3- que aparecen incoloros porque sus transiciones d-d están en el ultravioleta. Otros complejos como [Mn (H 2 O)] 6 2+ están débilmente coloreados porque sus transiciones d-d implican un cambio en el estado de espín del complejo.