5.5: Enlace p entre metales y ligandos
- Page ID
- 72346
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Un factor importante que contribuye a la alta fuerza de campo del ligando de ligandos tales como CO, CN - y fosfinas es el enlace π entre el metal y el ligando. Hay tres tipos de unión pi en complejos metálicos:
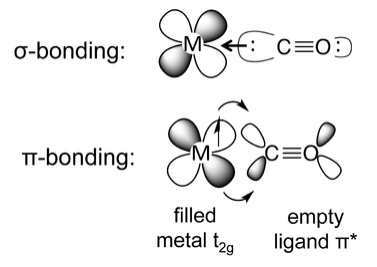
La situación más común es cuando un ligando como el monóxido de carbono o cianuro dona sus electrones sigma (no enlazantes) al metal, al tiempo que acepta la densidad de electrones del metal a través del solapamiento de un metal t 2g orbital y un ligando π* orbital. Esta situación se llama "backbonding" porque el ligando dona densidad de electrones σal metal y el metal dona densidad de electrones π al ligando. El ligando actúa así como un donador σy un aceptor π. En π-backbonding, el metal dona electrones π al ligando π* orbital, agregando densidad electrónica a un orbital molecular antienlace. Esto da como resultado un debilitamiento del enlace C-O, que se observa experimentalmente como alargamiento del enlace (relativo al CO libre en la fase gaseosa) y disminución de la frecuencia de estiramiento infrarrojo C-O.
La unión d-d π ocurre cuando un elemento tal fósforo, que tiene un par solitario de simetría σy un orbital 3d de metal vacío, se une a un metal que tiene electrones en un orbital t 2g. Esta es una situación común para los complejos de fosfina (por ejemplo, trifenilfosfina) unidos a metales de transición tardíos de baja valencia. El backbonding en este caso es análogo al ejemplo de CO, excepto que el orbital aceptor es un orbital 3d de fósforo en lugar de un orbital de ligando π*. Aquí el ligando de fosfina actúa como un donador σy un aceptor π, formando un enlace dπ-dπ.
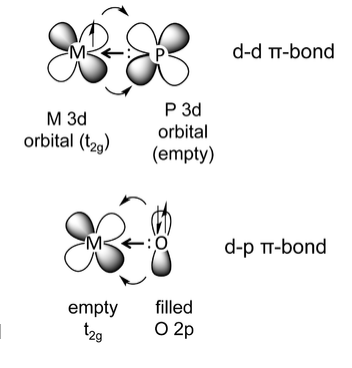
El tercer tipo de enlace π metal-ligando ocurre cuando un ligando donador π-un elemento con un par de electrones de simetría σy un orbital p ortogonal relleno - se une a un metal, como se muestra arriba a la derecha para un ligando O 2-. Esto ocurre en complejos tempranos de metales de transición. En este ejemplo, O 2- está actuando tanto como donante σcomo donador π. Esta interacción se dibuja típicamente como un enlace múltiple metal-ligando, por ejemplo, el enlace V=O en el catión vanadilo [VO] 2+. Los ligandos donadores típicos son óxido (O 2-), nitruro (N 3-), imida (RN 2-), alcóxido (RO -), amida (R 2 N -) y fluoruro (F -). Para los metales de transición tardíos, los donadores π fuertes forman interacciones antienlace con los niveles d llenos, con consecuencias para el estado de espín, los potenciales redox y las tasas de intercambio de ligandos. Los ligandos donadores π son bajos en la serie espectroquímica. [5]
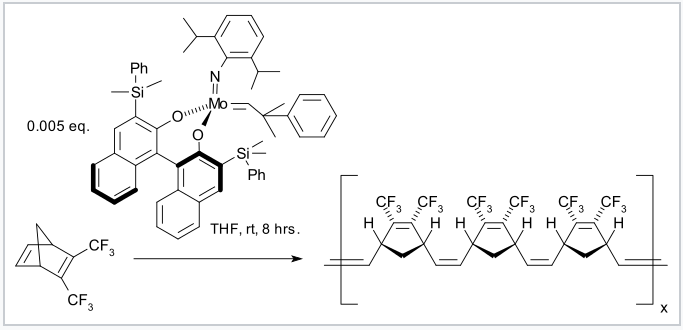
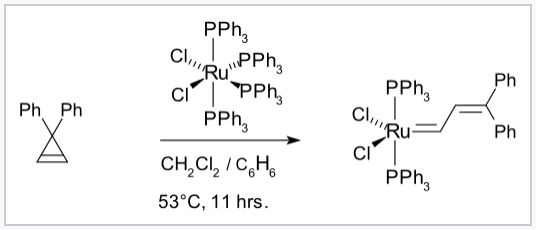
Los ligandos que contienen carbono que son donadores π y sus complejos con iones de metales de transición son muy importantes en la metátesis de olefinas, una reacción en la que se intercambian dobles enlaces carbono-carbono. Usando estos catalizadores, las olefinas cíclicas pueden transformarse en polímeros lineales con alto rendimiento a través de la polimerización por metátesis de apertura de anillo (ROMP). Catalizadores de este tipo fueron desarrollados por los grupos de Richard Schrock y Robert Grubbs, quienes compartieron el Premio Nobel de Química 2005 con Yves Chauvin por sus descubrimientos. Los catalizadores Schrock se basan en metales de transición tempranos como Mo; son más reactivos pero menos tolerantes a diferentes grupos funcionales orgánicos y solventes próticos que los catalizadores Grubbs, los cuales se basan en complejos de Ru.
|
Un catalizador de Schrock quiral polimeriza un derivado de norbornadieno a un polímero isotáctico altamente estereorregular. [6] |
|
Síntesis de un catalizador de metátesis de olefinas de Grubbs. [7] |