5.6: Energía de estabilización de campo cristalino, emparejamiento y regla de perro
- Page ID
- 72324
La división de los orbitales d en diferentes niveles de energía en los complejos de metales de transición tiene importantes consecuencias para su estabilidad, reactividad y propiedades magnéticas. Consideremos primero el caso simple de los complejos octaédricos [M (H 2 O) 6] 3+, donde M = Ti, V, Cr. Debido a que los complejos son octaédricos, todos tienen el mismo diagrama de nivel de energía:
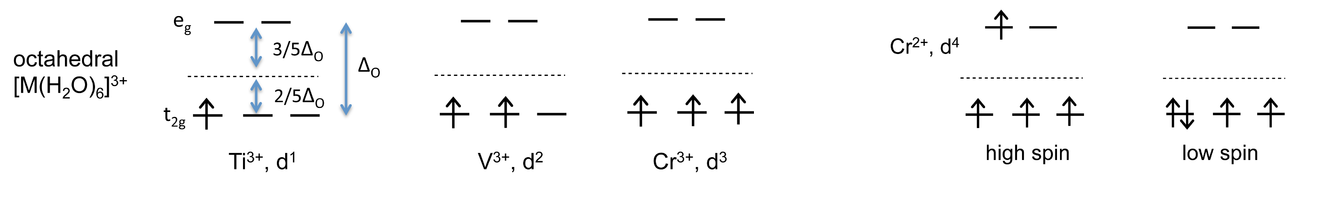
Los complejos Ti 3+, V 3+ y Cr 3+ tienen uno, dos y tres electrones d respectivamente, los cuales llenan los orbitales degenerados t 2g individualmente. Los giros se alinean paralelos de acuerdo con la regla de Hund, que establece que el estado de energía más bajo tiene el momento angular de giro más alto.
Para cada uno de estos complejos podemos calcular una energía de estabilización de campo cristalino, CFSE, que es la diferencia de energía entre el complejo en su estado fundamental y en un estado hipotético en el que los cinco orbitales d están en el baricentro de energía.
Para Ti 3+, hay un electrón estabilizado por 2/5 Δ O, entonces\(CFSE= -(1)(\frac{2}{5})(\Delta_{O}) = \frac{-2}{5} \Delta_{O}\)
De igual manera, CFSE = -4/5 Δ O y -6/5 Δ O para V 3+ y Cr 3+, respectivamente.
Para los complejos Cr 2+, que tienen cuatro electrones d, la situación es más complicada. Ahora podemos tener una configuración de espín alto (t 2g) 3 (e g) 1, o una configuración de espín bajo (t 2g) 4 (e g) 0 en la que se emparejan dos de los electrones. ¿Cuáles son las energías de estos dos estados?
Alto giro:\(CFSE= (-3)(\frac{2}{5})\Delta_{O} + (1)(\frac{3}{5})\Delta_{O} = -\frac{3}{5}\Delta_{O}\)
Giro bajo:\(CFSE= (-4)(\frac{2}{5})\Delta_{O} + P = -\frac{8}{5} \Delta_{O} + P\), donde P es la energía de emparejamiento
Diferencia de energía = -Δ O + P
La energía de emparejamiento P es la penalización de energía por poner dos electrones en un mismo orbital, resultante de la repulsión electrostática entre electrones. Para elementos 3d, un valor típico de P es de aproximadamente 15,000 cm -1.
El resultado importante aquí es que un complejo será bajo spin si Δ O > P, y alto spin si Δ O < P.
Debido a que Δ O depende tanto de los metales como de los ligandos, determina el estado de espín del complejo.
Reglas de pulgar:
Los complejos 3d son de alto espín con ligandos de campo débiles y de espín bajo con ligandos de campo fuertes.
Los complejos 3d de alta valencia (por ejemplo, complejos de Co 3+) tienden a ser de bajo espín (δ O grande)
Los complejos 4d y 5d son siempre de bajo espín (grande Δ O)
Tenga en cuenta que los estados de espín alto y bajo ocurren solo para complejos metálicos 3d con entre 4 y 7 electrones d. Los complejos con 1 a 3 electrones d pueden acomodar todos los electrones en orbitales individuales en el conjunto t 2g. Los complejos con 8, 9 o 10 electrones d siempre habrán llenado completamente t 2g orbitales y 2-4 electrones en el conjunto e g.
|
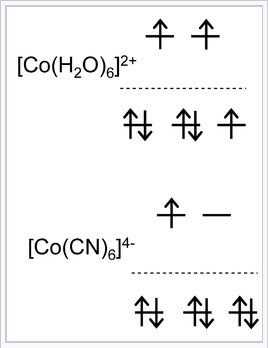
Diagramas de energía orbital d para complejos de Co 2+ de alto y bajo espín, d 7 |
Ejemplos de complejos de espín alto y bajo:
[Co (H 2 O) 6 2+] contiene un ión metálico d 7 con un ligando de campo débil. Se sabe que este complejo es de alto espín a partir de mediciones de susceptibilidad magnética, que detectan tres electrones desapareados por molécula. Su ocupación orbital es de (t 2g) 5 (e g) 2.
Podemos calcular el CFSE como\(-(5)(\frac{2}{5})\Delta_{O} + (2)(\frac{3}{5})\Delta_{O} = -\frac{4}{5} \Delta_{O}\)
[Co (CN) 6 4-] también es un complejo octaédrico d 7 pero contiene CN -, un fuerte ligando de campo. Su ocupación orbital es (t 2g) 6 (e g) 1 y por lo tanto tiene un electrón desapareado.
En este caso el CFSE es\(-(6)(\frac{2}{5})\Delta_{O} + (1)(\frac{3}{5})\Delta_{O} + P = -\frac{9}{5}\Delta_{O} + P.\)
Magnetismo de complejos de metales de transición
Los compuestos con electrones desapareados tienen un momento magnético inherente que surge del espín electrónico. Dichos compuestos interactúan fuertemente con los campos magnéticos aplicados. Su susceptibilidad magnética proporciona una manera sencilla de medir el número de electrones desapareados en un complejo de metal de transición.
Si un complejo de metal de transición no tiene electrones desapareados, es diamagnético y se repele débilmente de la región de campo alto de un campo magnético no homogéneo. Los complejos con electrones desapareados son típicamente paramagnéticos. Los giros en los paramagnets se alinean independientemente en un campo magnético aplicado pero no se alinean espontáneamente en ausencia de un campo. Dichos compuestos son atraídos por un imán, es decir, son atraídos hacia la región de campo alto de un campo no homogéneo. La fuerza de atracción, que puede medirse con una balanza Guoy o un magnetómetro SQUID, es proporcional a la susceptibilidad magnética (χ) del complejo.
El momento magnético efectivo de un ion (µ eff), en ausencia de acoplamiento espín-órbita, viene dado por la suma de su espín y momentos orbitales:
\[\mathbf{\mu_{eff}= \mu_{spin} + \mu_{orbital} = \mu_{s} + \mu_{L}}\]
En los complejos metálicos octaédricos 3d, el momento angular orbital se “apaga” en gran medida por la simetría, por lo que podemos aproximarnos:
\[\mathbf{\mu_{eff} \approx \mu_{s}}\]
Podemos calcular µ s a partir del número de electrones desapareados (n) usando:
\[\mu_{eff} = \sqrt{n(n+2)}\mu_{B}\]
Aquí µ B es el magnetón Bohr (= eh/4πm e) = 9.3 x 10 -24 J/T Esta fórmula de solo giro es una buena aproximación para complejos de metales de transición de primera fila, especialmente complejos de alto espín. La siguiente tabla compara los valores calculados y medidos experimentalmente de µ eff para complejos octaédricos con 1-5 electrones desapareados.
| Ion | Número de electrones desapareados |
Momento de solo giro /μ B |
momento observado /μ B |
|---|---|---|---|
| Ti 3+ | 1 | 1.73 | 1.73 |
| V 4+ | 1 | 1.68—1.78 | |
| Cu 2+ | 1 | 1.70—2.20 | |
| V 3+ | 2 | 2.83 | 2.75—2.85 |
| Ni 2+ | 2 | 2.8—3.5 | |
| V 2+ | 3 | 3.87 | 3.80—3.90 |
| Cr 3+ | 3 | 3.70—3.90 | |
| Co 2+ | 3 | 4.3—5.0 | |
| Mn 4+ | 3 | 3.80—4.0 | |
| Cr 2+ | 4 | 4.90 | 4.75—4.90 |
| Fe 2+ | 4 | 5.1—5.7 | |
| Mn 2+ | 5 | 5.92 | 5.65—6.10 |
| Fe 3+ | 5 | 5.7—6.0 |
Las pequeñas desviaciones de la fórmula de solo giro para estos complejos octaédricos pueden ser el resultado del descuido del momento angular orbital o del acoplamiento espín-órbita. Los complejos tetraédricos d 3, d 4, d 8 y d 9 tienden a mostrar mayores desviaciones de la fórmula de solo espín que los complejos octaédricos del mismo ión porque la extinción de la contribución orbital es menos efectiva en el caso tetraédrico.
Resumen de reglas para complejos de espín alto y bajo:
Complejos 3d: Pueden ser de espín alto o bajo, dependiendo del ligando (d 4, d 5, d 6, d 7)
Complejos 4d y 5d: Siempre bajo giro, porque Δ O es grande
El CFSE máximo es para los casos d 3 y d 8 (por ejemplo, Cr 3+, Ni 2+) con ligandos de campo débiles (H 2 O, O 2-, F -,...) y para d 3 -d 6 con ligandos de campo fuertes (Fe 2+, Ru 2+, Os 2+, Co 3+, Rh 3+, Ir 3+,...)
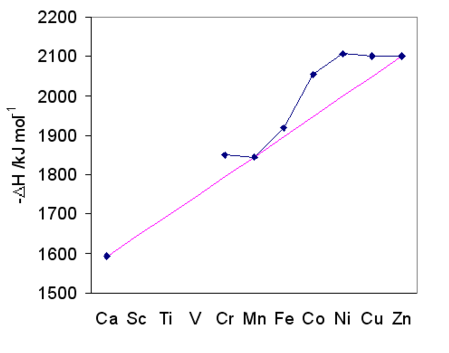
Serie Irving-Williams. Para los complejos M 2+, la estabilidad del complejo sigue el orden Mg 2+ < Mn 2+ < Fe 2+ < Co 2+ < Ni 2+ < Cu 2+ > Zn 2+. Esta tendencia representa el aumento de la acidez de Lewis a medida que los iones se vuelven más pequeños (yendo de izquierda a derecha en la tabla periódica) así como la tendencia en CFSE. Esta misma tendencia se refleja en la entalpía de hidratación de iones M 2+ en fase gaseosa, como se ilustra en la gráfica de la derecha. Tenga en cuenta que Ca 2+, Mn 2+ y Zn 2+, que son d 0, d 5 (alto espín), y d 10 iones aquo, respectivamente, tienen cero CFSE y caen en la misma línea. Los iones que más se desvían de la línea como Ni 2+ (octaédrico d 8) tienen los mayores CFSE.
Colores y espectros de complejos de metales de transición
Los complejos de metales de transición suelen tener hermosos colores porque, como se señaló anteriormente, sus energías de transición d-d pueden estar en la parte visible del espectro. Con los complejos octaédricos estos colores son tenues (las transiciones son débiles) porque violan la regla de selección de Laporte. De acuerdo con esta regla, las transiciones g -> g y u -> u están prohibidas en los complejos centrosimétricos. Los orbitales d tienen simetría g (gerade), por lo que las transiciones d-d están prohibidas en Laporte. Sin embargo, los complejos octaédricos pueden absorber luz cuando se distorsionan momentáneamente lejos de la centrosimetría a medida que la molécula vibra. Los giros de giro también están prohibidos en las transiciones ópticas por la regla de selección de giro, por lo que el estado excitado siempre tendrá la misma multiplicidad de giro que el estado fundamental.
Los espectros de incluso los complejos de metales de transición más simples son bastante complicados debido a las muchas formas posibles en que los electrones d pueden llenar los orbitales t 2g y e g. Por ejemplo, si consideramos un complejo d 2 como V 3+ (aq), sabemos que los dos electrones pueden residir en cualquiera de los cinco orbitales d, y pueden ser spin-up o spin-down. En realidad hay 45 arreglos diferentes de este tipo (llamados microestados) que no violan el principio de exclusión de Pauli para un complejo d 2. Normalmente nos preocupan sólo los seis de menor energía, en los que ambos electrones ocupan orbitales individuales en el conjunto de t 2g y todos sus espines están alineados ya sea hacia arriba o hacia abajo.
|
De izquierda a derecha: [V (H 2 O) 6] 2+ (lila), [V (H 2 O) 6] 3+ (verde), [VO (H 2 O) 5] 2+ (azul) y [VO (H 2 O) 5] 3+ (amarillo). |
Podemos ver cómo estos microestados juegan un papel en los espectros electrónicos cuando consideramos las transiciones d-d del ion [Cr (NH 3) 6] 3+. Este ion es d 3, por lo que cada uno de los tres orbitales t 2g contiene un electrón desapareado. Esperamos ver una transición cuando uno de los tres electrones en los orbitales t 2g se excita a un orbital e g vacío. Curiosamente, no encontramos una sino dos transiciones en lo visible.
La razón por la que vemos dos transiciones es que el electrón puede provenir de cualquiera de los orbitales t 2g y terminar en cualquiera de los orbitales e g. Supongamos por el bien del argumento que el electrón está inicialmente en el orbital d xy. Se puede excitar ya sea al orbital d z 2 o al d x 2 -y 2:
\(d_{xy} \rightarrow d_{z^{2}}\)(mayor energía)
\(d_{xy} \rightarrow d_{x2-y2}\)(menor energía)
La primera transición es a mayor energía (longitud de onda más corta) porque en el estado excitado la configuración es (d yz 1 d xz 1 d z 2 1). Los tres orbitales de estado excitado tienen algún componente z, por lo que la densidad de electrones d se “apila” a lo largo del eje z. La energía de esta transición es así incrementada por la repulsión electrón-electrón. En el segundo caso, la configuración del estado excitado es (d yz 1 d xz 1 d x 2 -y 2 1), y los electrones d están más simétricamente distribuidos alrededor del metal. Este efecto es responsable de una división de las bandas d-d en aproximadamente 8,000 cm -1. Podemos demostrar que todas las demás transiciones posibles son equivalentes a una de estas dos por simetría, y por lo tanto solo vemos dos bandas de absorción visibles para los complejos de Cr 3+.