5.7: Complejos no octaédricos
- Page ID
- 72323
Las geometrías no octaédricas más importantes para los complejos de metales de transición son:
4 coordenadas: plano cuadrado y tetraédrico
5 coordenadas: piramidal cuadrado y bipiramidal trigonal
|
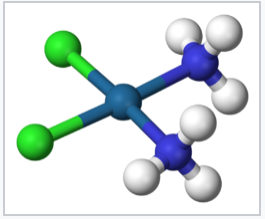
Cis-Pt (NH 3) 2 Cl 2, un complejo plano cuadrado 5d 8 |
|
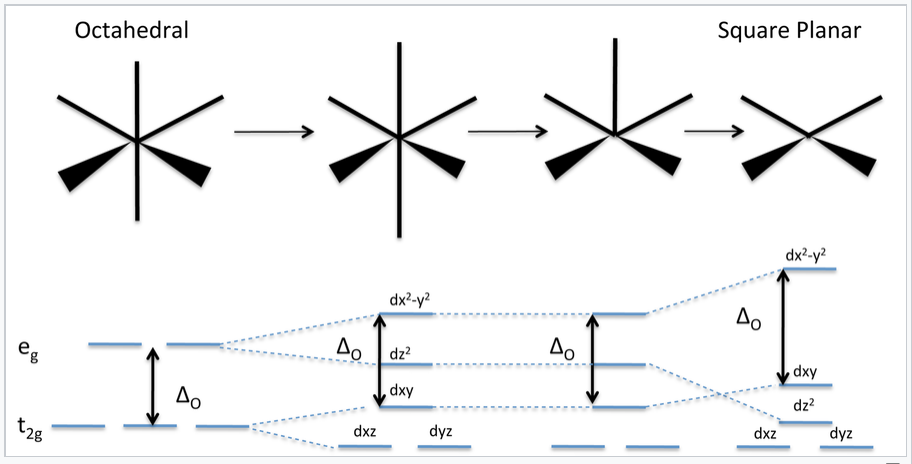
Diagrama de energía de campo cristalino que muestra la transición de geometría octaédrica a geometría plana cuadrada |
Energías de los orbitales d en geometrías no octaédricas
La figura anterior muestra lo que sucede con el diagrama de energía d-orbital a medida que distorsionamos progresivamente un complejo octaédrico alargándolo a lo largo del eje z (una distorsión tetragonal), eliminando uno de sus ligandos para hacer una pirámide cuadrada, o eliminando ambos ligandos a lo largo del z- eje para hacer un complejo plano cuadrado. En todos los casos, mantenemos el mismo orden de enlace total al hacer que los enlaces en el plano xy sean más cortos a medida que los enlaces en la dirección z se estiran y/o se rompen.
|
Barnett Rosenberg (Michigan State University) descubrió accidentalmente los efectos biológicos del cis-PT plano cuadrado (NH 3) 2 Cl 2 mientras investigaba el crecimiento bacteriano en campos eléctricos. [8] El electrodo de Pt que utilizó reaccionó con iones cloruro y amonio en el electrolito para producir el compuesto a una concentración de 1-10 ppm. Otros experimentos revelaron que el isómero cis (pero no el isómero trans) es un potente fármaco anticanceroso que es especialmente efectivo contra el cáncer testicular. El fármaco funciona reticulando regiones ricas en guanina-citosina del ADN, inhibiendo así la división celular. |
La distorsión alejada de la simetría octaédrica rompe la degeneración de los orbitales t 2g y e g. Los orbitales d con un componente z (d xz, d yz, d z 2) descienden en energía como orbitales que residen en el plano xy (d xy, d x 2 -y 2) aumento de energía. El baricentro (la energía orbital promedio ponderada) permanece constante. Además, es importante señalar que la división entre los orbitales d xy y d x 2 -y 2 permanece constante en Δ O independientemente de la naturaleza de la distorsión.
¿Por qué un complejo octaédrico “feliz” querría perder dos de sus ligandos para hacer un complejo plano cuadrado? Esto ocurre frecuentemente en d 8 y algunas veces en complejos d 9 con grandes Δ O, es decir, complejos 3d 8 con ligandos de campo fuertes y complejos 4d 8, 5d 8 con cualquier ligando. Ejemplos de tales complejos d 8 son [Ni (CN) 4] 2-, el fármaco anticancerígeno cisplatino (cis-Pt (NH 3) 2 Cl 2), [Pd (H 2 O) 4] 2+ y [AUCl 4] -. En el conteo de electrones d 8, se llenan los cuatro orbitales más bajos y el orbital más alto (el d x 2 -y 2) está vacío, lo que resulta en un CFSE grande. Estos complejos son diamagnéticos y tienden a ser bastante estables. Con ligandos de campo débil, los complejos 3d 8 son octaédricos y paramagnéticos (e.g., [Ni (H 2 O) 6] 2+, que tiene dos electrones desapareados en los orbitales e g.
Complejos planos cuadrados en catálisis:
Los complejos d 8 planos cuadrados pueden ser oxidados por dos electrones para convertirse en complejos octaédricos (bajo espín) d 6, que también tienen un CFSE grande. Debido a que la pérdida de dos electrones va acompañada de la ganancia de dos ligandos, este proceso se denomina adición oxidativa. El proceso inverso se llama eliminación reductiva. Ambos procesos funcionan juntos en ciclos catalíticos, como la hidrogenación de olefinas usando el catalizador de Wilkinson. [10] [11] A continuación se muestra el ciclo catalítico.
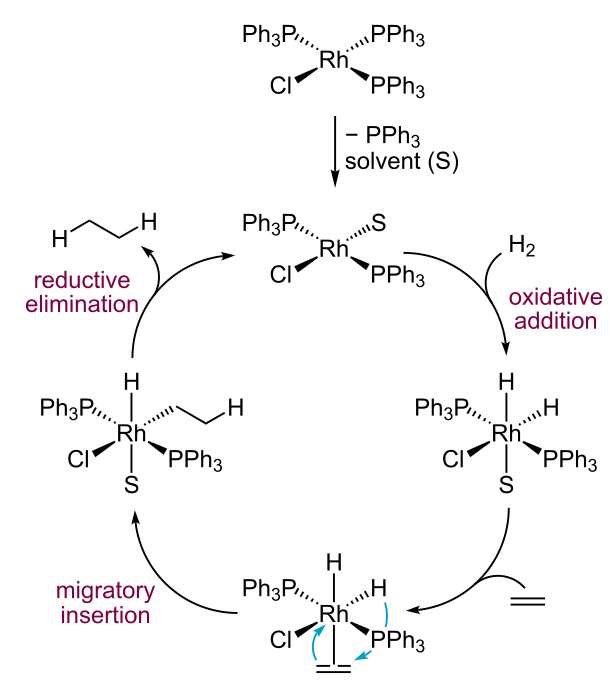
El catalizador realiza ciclos entre 4 coordenadas Rh (I) (4d 8) y 6 coordenadas Rh (III) (4d 6). El complejo primero agrega H 2 oxidativamente, para dar un complejo de seis coordenadas en el que el hidrógeno es formalmente H -. Una molécula de olefina desplaza una molécula solvente, usando sus electrones π para coordinar el metal. El complejo se reorganiza insertando la olefina en el enlace metal-hidrógeno, un proceso llamado inserción migratoria. Finalmente, el complejo vuelve a la geometría plana cuadrada eliminando la olefina hidrogenada (eliminación reductora). El catalizador de Wilkinson es altamente activo y se usa ampliamente para reacciones homogéneas de hidrogenación, hidroboración e hidrosilación. [12] [13] Con ligandos de fosfina quirales, el catalizador puede hidrogenar olefinas proquirales para dar productos enantioméricamente puros. [14]
|
Sir Geoffrey Wilkinson, químico inorgánico del Imperial College de Londres, desarrolló el catalizador de Wilkinson en 1966. Anteriormente, como profesor asistente en la Universidad de Harvard, había dilucidado la estructura sándwich del ferroceno, [9] que había sido descubierta algunos años antes pero no entendida. Wilkinson fue galardonado con el Premio Nobel de Química en 1973 por sus contribuciones a la química organometálica. |