5.11: Quelato y Efectos Macrocíclicos
- Page ID
- 72284
Los ligandos que contienen más de un sitio de unión para un ion metálico se denominan ligandos quelantes (de la palabra griega χηλ, chēlē, que significa “garra”). Como su nombre lo indica, los ligandos quelantes tienen una alta afinidad por los iones metálicos en relación con los ligandos con un solo grupo de unión (que se denominan ligandos monodentados = “diente único”).
|
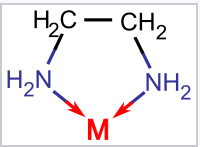
La etilendiamina (en) es un ligando bidentado que forma un anillo de cinco miembros en coordinación con un ion metálico M |
Considere los dos equilibrios de complejación en solución acuosa, entre el ion cobalto (II), Co 2 + (aq) y etilendiamina (en) por un lado y amoníaco, NH 3, por otro.
\(\ce{[Co(H2O)6]^{2+} + 6NH3 \rightleftharpoons [Co(NH3)6]^{2+} + 6H2O}\)(1)
\(\ce{[Co(H2O)6]^{2+} + 3en \rightleftharpoons [Co(en)3]^{2+} + 6H2O}\)(2)
Electrónicamente, los ligandos amoníaco y en son muy similares, ya que ambos se unen a través de N y ya que las fuerzas de base de Lewis de sus átomos de nitrógeno son similares. Esto significa que ΔH° debe ser muy similar para las dos reacciones, ya que en cada caso se forman seis enlaces Co-N. Curiosamente, sin embargo, observamos que la constante de equilibrio es 100,000 veces mayor para la segunda reacción que para la primera.
La gran diferencia entre estas dos reacciones es que la segunda implica la “condensación” de menos partículas para hacer el complejo. Esto significa que los cambios de entropía para las dos reacciones son diferentes. La primera reacción tiene un valor ΔS° cercano a cero, porque hay el mismo número de moléculas en ambos lados de la ecuación. El segundo tiene un ΔS° positivo porque cuatro moléculas se unen pero se producen siete moléculas. La diferencia entre ellos (ΔΔS°) es de aproximadamente +100 J/mol-K. Podemos traducir esto en una relación de constantes de equilibrio usando:
K f (es) /K f (NH 3) = e -ΔΔG°/RT ≈ e +ΔΔS°/R ≈ e 12 ≈ 10 5
\[\frac{K_{f}(en)}{K_{f}(NH_{3})} = e^{\frac{-\Delta\Delta G^{o}}{RT}} \approx e^{\frac{+\Delta \Delta S^{o}}{R}} \approx e^{12} \approx 10^{5}\]
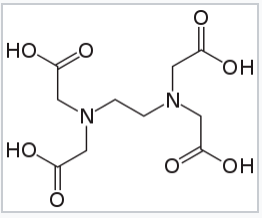
La conclusión es que el efecto quelato es impulsado por entropía. De ello se deduce que cuantos más grupos de unión contenga un ligando, más positivo será ΔS° y mayor será Kf para la formación de complejos. En este sentido, el ligando hexadentado ácido etilendiamina tetraacético (EDTA) es un ligando óptimo para la elaboración de complejos octaédricos debido a que tiene seis grupos de unión. En soluciones básicas donde los cuatro grupos COOH están desprotonados, el efecto quelato del ligando EDTA 4 es aproximadamente 10 15. Esto significa que, para un ion metálico dado, K f es 10 15 veces mayor para EDTA 4 - de lo que sería para los ligandos monodentados relevantes a la misma concentración. EDTA 4 - se une fuertemente esencialmente a cualquier ion 2+, 3+ o 4+ en la tabla periódica, y es un ligando muy útil tanto para aplicaciones analíticas como para separaciones.
|
Ácido etilendiaminotetraacético (EDTA), un ligando hexadentado |
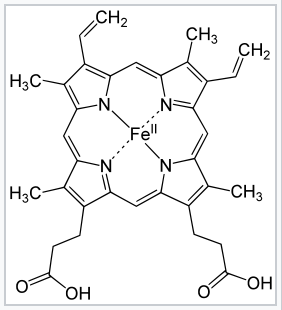
El efecto macrocíclico sigue el mismo principio que el efecto quelato, pero el efecto se ve potenciado aún más por la conformación cíclica del ligando. Los ligandos macrocíclicos no solo son multidentados, sino que debido a que están covalentemente restringidos a su forma cíclica, permiten menos libertad conformacional. Se dice que el ligando está "preorganizado" para la unión, y hay poca penalización por entropía para envolverlo alrededor del ion metálico. Por ejemplo, el hemo b es un ligando cíclico tetradentado que es fuertemente complejo con iones de metales de transición, incluyendo (en sistemas biológicos) Fe +2.
|
Heme b |
Algunos otros ligandos quelantes y cíclicos comunes se muestran a continuación:
El acetilacetonato (acac -, derecha) es un ligando bidentado aniónico que coordina los iones metálicos a través de dos átomos de oxígeno. Acac - es una base dura por lo que prefiere cationes ácidos duros. Con iones metálicos divalentes, acac - forma complejos volátiles neutros como Cu (acac) 2 y Mo (acac) 2 que son útiles para la deposición química de vapor (CVD) de películas delgadas metálicas.
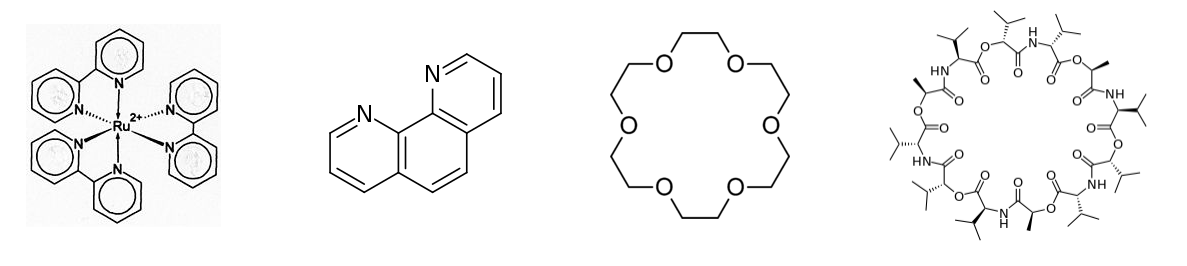
2,2'-Bipiridina y ligandos bidentados relacionados como 1,10-fenantrolina (abajo, centro izquierdo) forman complejos en forma de hélice con metales como Ru 2 +. El complejo [Ru (bpy) 3] 2+ (abajo a la izquierda) es fotoluminiscente y también puede sufrir reacciones fotorredox, lo que lo convierte en un compuesto interesante tanto para la fotocatálisis como para la fotosíntesis artificial. Las formas del propulsor quiral de los complejos metálicos de polipiridilo como [Ru (bpy) 3] 2+ coinciden coincidentemente con el tamaño y la helicidad del surco mayor del ADN. Esto ha llevado a una serie de estudios interesantes de reacciones de transferencia de electrones a lo largo de la cadena principal del ADN, iniciadas por la fotoexcitación del complejo metálico.
|
La Prof. Jacqueline Barton (Caltech) ha utilizado complejos metálicos de polipiridilo para estudiar reacciones de transferencia de electrones que están implicadas en la detección biológica y reparación de daños en moléculas de ADN. |
Los éteres corona como 18-corona-6 (abajo, centro derecho) son bases duras cíclicas que pueden complejar cationes de metales alcalinos. Las coronas pueden unirse selectivamente a Li +, Na + o K + dependiendo del número de unidades de óxido de etileno en el anillo.
Las propiedades quelantes de los éteres corona son miméticas del antibiótico natural valinomicina (abajo a la derecha), que transporta selectivamente iones K + a través de las membranas celulares bacterianas, matando a la bacteria disipando su potencial de membrana. Al igual que los éteres corona, la valinomicina es una base dura cíclica.