6.4: Estructuras Cristalinas de Metales
- Page ID
- 71979
La naturaleza cristalina de los metales
Todos los elementos metálicos (excepto Cs, Ga y Hg) son sólidos cristalinos a temperatura ambiente. Al igual que los sólidos iónicos, los metales y aleaciones tienen una tendencia muy fuerte a cristalizar, ya sea que estén hechos por procesamiento térmico o por otras técnicas como reducción de solución o galvanoplastia. Los metales cristalizan fácilmente y es difícil formar un metal vítreo incluso con un enfriamiento muy rápido. Los metales fundidos tienen baja viscosidad, y los átomos idénticos (esencialmente esféricos) pueden empaquetarse en un cristal muy fácilmente. Los metales vítreos pueden fabricarse, sin embargo, enfriando rápidamente aleaciones, particularmente si los átomos constituyentes tienen diferentes tamaños. Los diferentes átomos no pueden empaquetarse en una celda unitaria simple, a veces haciendo que la cristalización sea lo suficientemente lenta como para formar un vidrio.
|
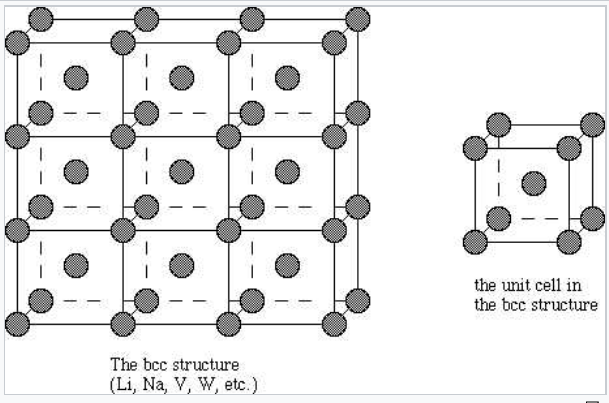
Cúbicos centrados en el cuerpo |
|
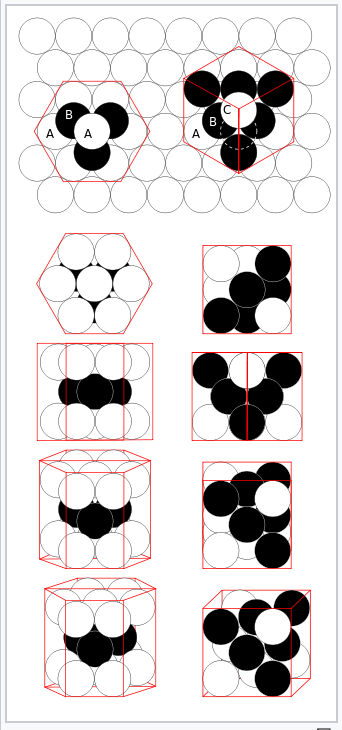
hcp (izquierda) y fcc (derecha) empaquetamiento cerrado de esferas |
Estructuras de cristal
La mayoría de los metales y aleaciones cristalizan en una de las tres estructuras muy comunes: cúbico centrado en el cuerpo (bcc), hexagonal empaquetado cerrado (hcp) o cúbico empaquetado cerrado (ccp, también llamado cúbico centrado en la cara, fcc). En las tres estructuras el número de coordinación de los átomos metálicos (es decir, el número de vecinos equidistantes más cercanos) es bastante alto: 8 para bcc y 12 para hcp y ccp. Podemos contrastarlo con los bajos números de coordinación (es decir, valencias bajas, como 2 para O, 3 para N o 4 para C) que se encuentran en los no metales. En la estructura bcc, los vecinos más cercanos están en las esquinas de un cubo que rodea el átomo metálico en el centro. En las estructuras hcp y ccp, los átomos empaquetan como balas de cañón apiladas o bolas de billar, en capas con una disposición de seis coordenadas. Cada átomo también tiene seis vecinos más cercanos de capas arriba y abajo. La secuencia de apilamiento es ABCABC... en la celosía ccp y ABAB... en hcp. En ambos casos, se puede demostrar que las esferas llenan 74% del volumen de la celosía. Esta es la fracción de volumen más alta que se puede llenar con una celosía de esferas iguales.
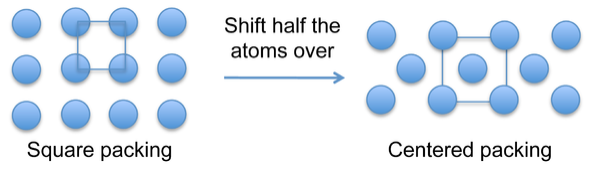
Los átomos en los cristales metálicos tienen una tendencia a empaquetarse en arreglos densos que llenan el espacio de manera eficiente. El empaque cuadrado simple (arriba) sobre el que se basa la estructura cúbica simple es ineficiente y, por lo tanto, raro entre las estructuras cristalinas metálicas. Las estructuras centradas en el cuerpo o la cara llenan el espacio de manera más eficiente y común.
Tendencias periódicas en la estructura y el comportamiento metálico
Recuerda dónde encontramos los elementos metálicos en la tabla periódica, en todas partes excepto en la esquina superior derecha. Esto significa que a medida que bajamos un grupo en el bloque p (digamos, grupo IVA, grupo carbono, o grupo VA, el grupo nitrógeno), las propiedades de los elementos cambian gradualmente de no metales a metaloides a metales. El grupo de carbono ilustra muy bien la transición. Comenzando por la parte superior, el elemento carbono tiene dos alótropos estables: grafito y diamante. En cada uno, la valencia de los átomos de carbono se satisface exactamente haciendo cuatro enlaces de pares de electrones a átomos vecinos. En grafito, cada carbono tiene tres vecinos más cercanos, por lo que hay dos enlaces simples y un doble enlace. En diamante, hay cuatro vecinos más cercanos situados en los vértices de un tetraedro, por lo que hay un enlace sencillo a cada uno.
Los dos elementos justo debajo del carbono (silicio y germanio) en la tabla periódica también tienen la estructura de diamante (recordemos que estos elementos no pueden hacer dobles enlaces consigo mismos fácilmente, por lo que no hay alótropo de grafito para Si o Ge). Si bien el diamante es un buen aislante, tanto el silicio como el germanio son semiconductores (es decir, metaloides). Mecánicamente, son duros como el diamante. Al igual que el carbono, cada átomo de Si y Ge satisface su valencia de cuatro al hacer enlaces sencillos a cuatro vecinos más cercanos.
El siguiente elemento bajo germanio es el estaño (Sn). El estaño tiene dos alótropos, uno con la estructura de diamante y otro con una estructura de bcc ligeramente distorsionada. Este último tiene propiedades metálicas (brillo metálico, maleabilidad) y conductividad aproximadamente 10 9 veces mayor que el Si. Finalmente, el plomo (Pb), el elemento bajo Sn, tiene la estructura ccp, y también es metálico. Tenga en cuenta las tendencias en número de coordinación y propiedades conductoras:
| Element | Estructura | Coord. no. | Conductividad |
|---|---|---|---|
| C | grafito, diamante | 3, 4 | semimetal, aislador |
| Si | diamante | 4 | semiconductores |
| Ge | diamante | 4 | semiconductores |
| Sn | diamante, bcc distorsionado | 4, 8 | semiconductor, metal |
| Pb | ccp | 12 | metal |

Los elementos C, Si y Ge obedecen a la regla del octeto, y podemos identificar fácilmente los enlaces de pares de electrones en sus estructuras. Sn y Pb, por otro lado, adoptan estructuras con altos números de coordinación. No tienen suficientes electrones de valencia para hacer enlaces de pares de electrones a cada vecino (esta es una característica común de los metales). Lo que sucede en este caso es que los electrones de valencia se “manchan” o deslocalizan sobre todos los átomos del cristal. Lo mejor es pensar en la unión en los metales como una disposición cristalina de núcleos cargados positivamente con un “mar” de electrones de valencia compartidos pegando la estructura. Debido a que los electrones no están localizados en ningún enlace particular entre átomos, pueden moverse en un campo eléctrico, razón por la cual los metales conducen bien la electricidad. Otra forma de describir la unión en metales es no direccional. Es decir, los vecinos más cercanos de un átomo lo rodean en todas direcciones, más que en algunas direcciones particulares (como en las esquinas de un tetraedro, como encontramos para el diamante). Los no metales (aisladores y semiconductores), por otro lado, tienen unión direccional. Debido a que la unión es no direccional y los números de coordinación son altos, es relativamente fácil deformar la esfera de coordinación (es decir, romper o estirar los enlaces) que en el caso de un no metal. Es por ello que elementos como el Pb son mucho más maleables que C, Si o Ge.