6.7: Orbitales atómicos y magnetismo
- Page ID
- 71931
El cuadro MO que desarrollamos en la Sección 6.4 nos ayuda a racionalizar la conductividad eléctrica del Na (3s 1), pero ¿qué pasa con el Mg, que (como átomo en la fase gaseosa) tiene una configuración electrónica 3s 2? Los dos electrones de valencia están emparejados por espín en Mg atómico, ya que están en el átomo de helio (1s 2). Cuando los orbitales 3s de Mg se combinan para formar una banda, esperaríamos que la banda estuviera completamente llena, ya que Mg tiene dos electrones por orbital. Por este razonamiento, el Mg sólido debe ser un aislante. Pero el Mg tiene todas las propiedades de un metal: alta conductividad eléctrica y térmica, brillo metálico, maleabilidad, etc. En este caso las bandas 3s y 3p son suficientemente amplias (debido a la fuerte superposición orbital entre los átomos de Mg) que forman una banda continua. Esta banda, que contiene un total de cuatro orbitales (uno 3s y tres 3p) por átomo, sólo está parcialmente llena por los dos electrones de valencia.
|
Cristales de Mg |
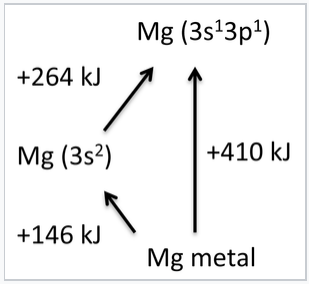
Otra forma de pensar al respecto es considerar la hibridación de los electrones 3s y 3p en Mg. La hibridación requiere la promoción del estado fundamental 3s 2 3p 0 de un átomo de Mg a un estado excitado de 3s 1 3p 1. La energía de promoción (+264 kJ/mol) está más que compensada por la energía de unión (-410 kJ/mol), la energía liberada cuando los átomos gaseosos en estado excitado se condensan para formar el sólido metálico. El calor de vaporización, o la energía cohesiva de un metal, es la diferencia entre la energía de unión y la energía de promoción. Experimentalmente, podemos medir la energía de vaporización (+146 kJ/mol) y la energía de promoción y utilizarlas para calcular la energía de unión. De esto aprendemos que cada electrón s o p vale alrededor de 200 kJ/mol en energía de unión. Los conceptos de energía de promoción y energía de unión son muy útiles para racionalizar tendencias periódicas en las resistencias de unión y propiedades magnéticas de los metales, las cuales se describen a continuación.
|
La energía cohesiva del metal Mg es la diferencia entre las energías de unión y promoción. El estado fundamental de un átomo de Mg en fase gaseosa es [Ar] 3s 2, pero puede promoverse al estado [Ar] 3s 1 3p 1, que es 264 kJ/mol por encima del estado fundamental. Mg utiliza dos electrones por átomo para hacer enlaces, y la energía de sublimación del metal es de 146 kJ/mol. |
Tendencias periódicas en la unión de electrones d
Mientras que los electrones en los orbitales s y p tienden a formar enlaces fuertes, los enlaces de electrones d pueden ser fuertes o débiles. Hay dos tendencias periódicas importantes que están relacionadas con el tamaño orbital y la superposición orbital. A medida que avanzamos por la tabla periódica (Sc - Ti - V - Cr - Fe), los d orbitales se contraen debido al aumento de la carga nuclear. Al bajar la tabla periódica (V - Nb - Ta), los d orbitales se expanden debido al incremento en el número cuántico principal. Estas tendencias explican el comportamiento distinto de los elementos 3d en relación con los de las series 4d y 5d. En la serie 3d, la contracción de los orbitales afecta la capacidad de los electrones d para contribuir a la unión. Pasado V en la primera fila de los metales de transición, los electrones 3d se vuelven mucho menos efectivos en la unión porque se superponen débilmente con sus vecinos. La superposición débil de orbitales 3d da bandas d estrechas y da como resultado la aparición de propiedades magnéticas como se analiza a continuación.
|
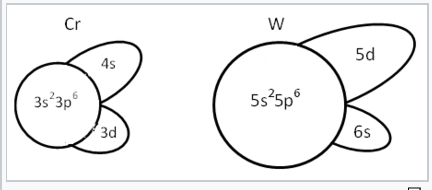
Representación esquemática de los tamaños de diferentes orbitales de Cr y W. En la primera serie de transición, el blindaje de los orbitales 3d es pobre. Por lo tanto, los orbitales 4s y 4p son más efectivos en la vinculación que los 3d. En la tercera serie de transición, la situación se invierte. El aumento de la carga nuclear se siente con mayor fuerza por los 6s, que adquiere el carácter de un par de electrones inertes. Los orbitales 5d están bien protegidos por el caparazón n=4 completo, por lo que tienen una buena superposición orbital con los átomos vecinos. |
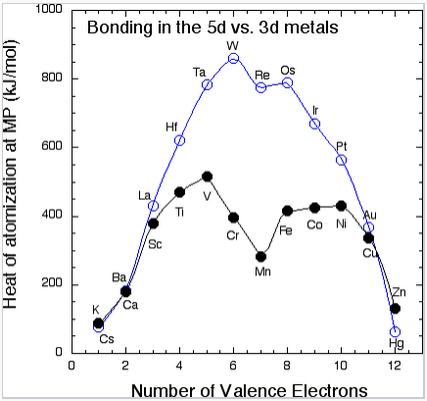
En las series 4d y 5d, una gráfica de energía cohesiva vs. número de electrones de valencia (abajo a la izquierda) tiene una forma de “volcán” que alcanza su punto máximo en los elementos Mo y W (5s 1 4d 5 y 6s 1 5d 5, respectivamente). El número de electrones de unión, y por lo tanto la energía de unión, aumenta constantemente pasando de Rb a Mo en la serie 4d, y de Cs a W en la serie 5d. Mo y W tienen la mayor energía de unión porque pueden usar los seis electrones de valencia en la unión sin promoción. Los elementos más allá de Mo y W tienen más electrones d, pero algunos de ellos están emparejados por espín y por lo tanto se necesita algo de energía de promoción para preparar estos electrones para la unión. Por ejemplo, el metal Pt debe promoverse del estado básico atómico 6s 1 5d 9 a 6s 1 5d 7 6p 2 para hacer seis enlaces por átomo, y el costo de energía de promover electrones de los orbitales 5d a 6p se refleja en la energía de unión neta. Debido a su fuerte energía de unión, los elementos en el medio de las series 4d y 5d tienen puntos de fusión muy altos. No vemos magnetismo en los metales 4d o 5d o sus aleaciones porque el solapamiento orbital es fuerte y la energía de unión excede la energía de emparejamiento electrónico.
|
El calor de vaporización (la energía cohesiva) de los metales en las series 3d y 5d, medido en el punto de fusión del metal. |
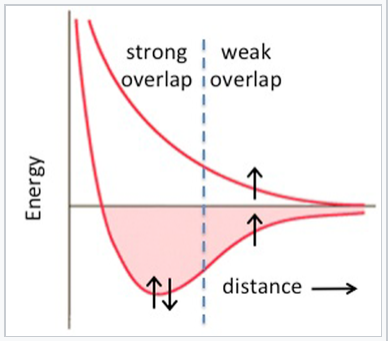
Los elementos 3d (Sc a Zn) son claramente diferentes de los elementos 4d y 5d en su unión (y consecuentemente en sus propiedades magnéticas). En la serie 3d, vemos el incremento esperado de la energía cohesiva pasando de Ca (4s 2) a Sc (4s 2 3d 1) a Ti (4s 2 3d 2) a V (4s 2 3d 3), pero luego sucede algo muy extraño. La serie 3d tiene un “cráter” en la parcela de energía cohesiva donde hubo un pico en la serie 5d. La energía cohesiva en realidad disminuye pasando de V a Mn, a pesar de que el número de electrones de valencia va en aumento. Podemos explicar este efecto recordando que los orbitales 3d se contraen progresivamente a medida que se agregan más protones al núcleo. Para los elementos más allá de V, el solapamiento orbital es tan pobre que los electrones 3d ya no son efectivos en la unión, y los electrones de valencia comienzan a desemparejarse. En este punto los elementos se vuelven magnéticos. Dependiendo de la forma en que ordenen los espines, los metales y aleaciones en esta parte de la tabla periódica pueden ser ferromagnéticos (espines sobre átomos vecinos alineados paralelos, como en el caso del Fe o Ni) o antiferromagnéticos (espines en átomos vecinos antiparalelos, como en el caso del Mn). Hemos visto antes el equilibrio entre el solapamiento orbital y el magnetismo (en el Capítulo 5) en el contexto de los complejos paramagnéticos de metales de transición. Cabe recordar que este comportamiento se predice en el diagrama de energía vs. distancia del átomo de hidrógeno (del Capítulo 2). A distancias interatómicas cortas (o con fuerte superposición entre orbitales atómicos), se forman los espines del par de electrones y un enlace. Desemparejar los electrones se vuelve favorable a mayores distancias interatómicas donde el solapamiento entre orbitales es pobre.
|
Con una fuerte superposición entre los orbitales de los átomos vecinos, la energía de enlace excede la energía de emparejamiento y los electrones del par de espinas. Con una superposición más débil, la unión es débil y los giros se desemparejan, dando como resultado un comportamiento magnético |
Curiosamente, muchas aleaciones de los elementos 4f (los lantánidos) también son magnéticas porque los orbitales 4f, al igual que los orbitales 3d, están mal protegidos de la carga nuclear y son ineficaces en la unión. Los imanes permanentes fuertes a menudo contienen aleaciones de Nd, Sm o Y, generalmente con elementos magnéticos 3d como Fe y Co.
Debido a que los orbitales 4f están contraídos y no son muy efectivos en la unión, otras propiedades físicas de los lantánidos también pueden verse afectadas. Por ejemplo, se ha propuesto que los óxidos de los elementos 4f tienen interacciones superficiales débiles con moléculas polares como el agua debido a la contracción f-orbital. Experimentalmente, se observa que CeO 2, Er 2 O 3 y Ho 2 O 3 son hidrófobos, mientras que el grupo principal y los óxidos de metales de transición tempranos (por ejemplo, Al 2 O 3, SiO 2, TiO 2) son bastante hidrófilos. [1]
Aleaciones de metales de transición tardía
Aunque la unión en la serie 5d sigue una trama volcánica “normal”, la situación es un poco más compleja para las aleaciones de Re, Os, Ir, Pt y Au. Existe una fuerte superposición entre los orbitales 5d, pero debido a que estos elementos contienen más de cinco electrones d por átomo, no pueden hacer tantos enlaces como elementos 4d o 5d con conchas d medio llenas como Mo o W. Este llenado progresivo de la banda d explica la disminución constante de la energía de unión que va de Os a Au. Pt y Au son ambos metales blandos con calores de vaporización relativamente bajos. Sin embargo, estos metales (especialmente Ir, Pt y Au) pueden combinarse con metales de transición temprana para formar aleaciones estables con calores de formación muy negativos y altos puntos de fusión. Por ejemplo, ZrC y Pt reaccionan para formar una serie de aleaciones estables (ZrPt, Zr 9 Pt 11, Zr 3 Pt 4, ZrPt 3) [2] más carbono. Esta reactividad es inusual porque normalmente pensamos en Pt como un metal “noble” (es decir, no reactivo), y porque ZrC es un carburo de metal refractario muy estable. La combinación favorable de metales de transición tempranos y tardíos ha sido interpretada como derivada de una interacción d-electrón “ácido-base”. [3] Por ejemplo, en HfPt 3, Hf es el “ácido” con una configuración electrónica de 6s 2 5d 2, mientras que Pt es la “base” con la configuración electrónica de 6s 1 5d 9. Se combinan para crear un producto estable de “sal” con una configuración de electrones 5d llena sin promover ningún electrón a orbitales superiores. La implicación es que Pt dona electrones d al “d-ácido”, Zr o Hf. Sin embargo, los cálculos de estructura electrónica en compuestos modelo muestran que gran parte de la energía de unión en ZrPt y ZrPt 3 surge de la transferencia de electrones de Zr a Pt (no al revés) y la polaridad de los enlaces metal-metal resultantes. [4] Independientemente de la fuente de su estabilidad, algunas aleaciones de metales de transición temprano-tardías son de particular interés para su uso en catálisis. Por ejemplo, la aleación sCPt 3 es un buen catalizador para la reducción de oxígeno en las celdas de combustible. Aunque el Sc es un metal activo que se oxida fácilmente, se estabiliza en el ambiente ácido acuoso de la pila de combustible por su fuerte interacción con el Pt. [5]
Relleno de las bandas 3d y 4s,4p
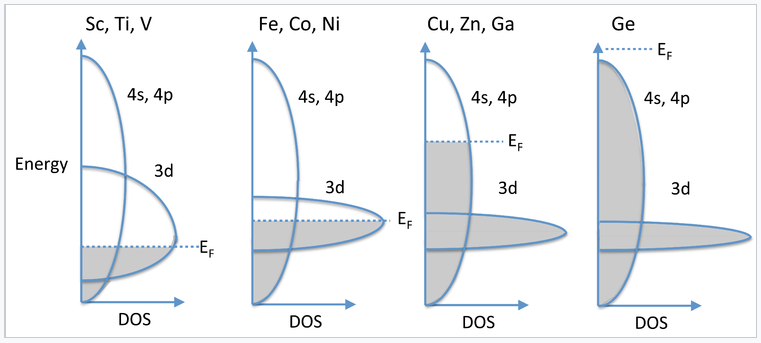
En la serie 3d, vemos comportamiento magnético para elementos y aleaciones entre Cr y Ni. Pasado Ni, los elementos (Cu, Zn, Ga,...) ya no son magnéticos y son muy buenos conductores eléctricos, lo que implica que sus electrones de valencia están altamente deslocalizados. Podemos entender este comportamiento considerando la superposición de orbitales 4s, 4p y 3d, todos los cuales son cercanos en energía. Los 4s y 4p tienen una fuerte superposición y forman una banda ancha y continua. Por otro lado, los electrones 3d se contraen y forman una banda relativamente estrecha. Avanzando desde los primeros elementos 3d (Sc, Ti, V), comenzamos a llenar los orbitales 3d, que aún no están tan contraídos que no puedan contribuir a la vinculación. Así, los electrones de valencia en Sc, Ti y V son todos espin-pareados, excepto por un pequeño número cercano al nivel Fermi que da lugar a un débil paramagnetismo Pauli. Moviéndose a través de la serie 3d hacia los elementos magnéticos (Fe, Co, Ni), los orbitales d están ahora tan contraídos que sus electrones se desemparejan y vemos un orden cooperativo de espines (ferromagnetismo y antiferromagnetismo). Refiriéndose al diagrama de bandas a la derecha, la banda 3d solo está parcialmente llena y el nivel de Fermi la atraviesa. Para Cu, Zn y Ga, los orbitales 3d están aún más contraídos y la banda 3d es así más estrecha, pero ahora está completamente llena y el nivel Fermi está en la banda 4s,4p. El fuerte solapamiento orbital en estas bandas da como resultado el emparejamiento de espines y un alto grado de deslocalización de electrones. En consecuencia, los metales en esta parte de la tabla periódica (Cu, Ag) son diamagnéticos y se encuentran entre los mejores conductores eléctricos a temperatura ambiente. Finalmente, en Ge, la banda 4s,4p está completamente llena y el sólido es un semiconductor.
|
Llenado progresivo de las bandas 3d y 4s,4p atravesando la tabla periódica de Sc a Ge. |
Los materiales se clasifican como diamagnéticos si no contienen electrones desapareados. Las sustancias diamagnéticas son muy débilmente repelidas de un campo magnético no homogéneo. Como aprendimos en el Capítulo 5, las moléculas o iones que tienen espines desapareados son paramagnéticos y son atraídos por un imán, es decir, se mueven hacia la región de campo alto de un campo no homogéneo. Esta fuerza atractiva resulta de la alineación de los espines con el campo, pero en el caso del paramagnetismo cada molécula actúa de manera independiente. En metales, aleaciones, óxidos y otros compuestos en estado sólido, los espines desapareados interactúan fuertemente entre sí y pueden ordenar espontáneamente, dando como resultado los fenómenos magnéticos cooperativos que se describen a continuación.