8.4: Estructuras Tetraédricas
- Page ID
- 71876
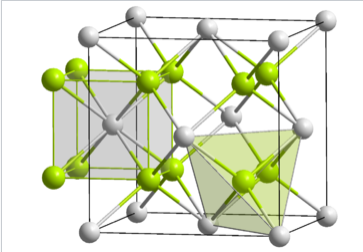
En celosías ccp y hcp, hay dos agujeros tetraédricos por átomo de empaque. Una estequiometría de M 2 X o MX 2 da una estructura que llena todos los sitios tetraédricos, mientras que una estructura MX llena solo la mitad de los sitios. Un ejemplo de una estructura MX 2 es la fluorita, CaF 2, cuya estructura se muestra en la figura de la izquierda. El átomo de empaquetamiento en la fluorita es Ca 2 + y la estructura está compuesta por tres redes interpenetrantes fcc. Cabe señalar que el ion Ca 2 + (esferas grises) como átomo empaquetador desafía nuestra “regla” de que los aniones son más grandes que los cationes y por lo tanto deben ser los átomos empaquetadores. La estructura de fluorita es común para compuestos iónicos MX 2 (MgF 2, ZrO 2, etc.) y M 2 X (Li 2 O). Por el contrario, el pariente hcp de la estructura de fluorita es bastante raro debido a los contactos cercanos desfavorables entre iones con carga similar.
|
La estructura cristalina de fluorita (CaF 2) que muestra los ambientes de coordinación de los átomos Ca y F |
En términos de geometría, Ca 2 + está en coordinación cúbica con ocho vecinos F -, y los iones fluoruro están coordinados tetraédricamente por cuatro iones Ca 2 +. La geometría de coordinación 8:4 es consistente con la estequiometría 1:2 Ca:F; en todas las estructuras cristalinas la relación de los números de coordinación es la inversa de la relación estequiométrica. Las tres celosías fcc interpenetrantes tienen Ca a 0,0,0, 1/2,1/2,0, etc... F a 1/4,1/4, 3/4,3/4,1/4, etc... y F a 3/4,3/4,3/4, 1/4,1/4/3/4, etc.
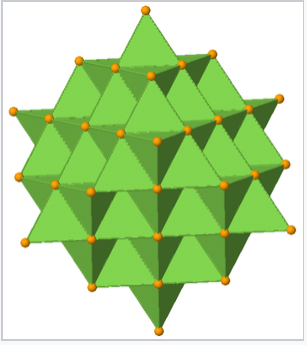
Al observar más de cerca los sitios tetraédricos en la fluorita, vemos que caen en dos grupos distintos: T + y T -. Si un tetraedro está orientado con un vértice apuntando hacia arriba a lo largo del eje de apilamiento, el sitio es T +. Asimismo, un tetraedro con un vértice orientado hacia abajo es T -. La alternancia de sitios T + y T - permite un empaquetamiento eficiente de iones en la estructura. La secuencia de apilamiento de capas en esta estructura (incluyendo iones fluoruro en los sitios T + y T -) es:
- — A
- - - -b- - - T +
- - - -a- - - T -
- — B
- - - -c- - - T +
- - - -b- - - T -
- — C
- - - -a- - - T +
- - - -c- - - T -
- — A
- - - -b- - - T +
- - - -a- - - T -
|
Vista poliédrica de la estructura cristalina de fluorita, mostrando tetraedros T + y T - Ca 4 F. Los iones Ca 2 + se apilan ABCABC... a lo largo de la diagonal del cuerpo de la celda unitaria, que es la dirección vertical en esta imagen. |
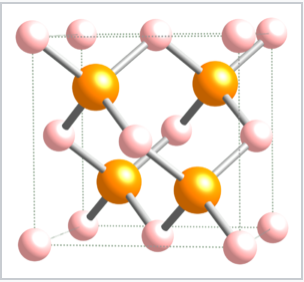
Los compuestos unidos tetraédricamente con una estequiometría 1:1 (compuestos MX) tienen solo la mitad de los sitios tetraédricos (ya sea los sitios T + o T -) llenos. En este caso, tanto los átomos M como los X están coordinados tetraedralmente. Las estructuras de zincblende y wurtzita son estructuras tetraédricas 1:1 basadas en celosías fcc y hcp, respectivamente. Ambas estructuras se ven favorecidas por compuestos de bloque p que siguen la regla del octeto, y estos compuestos suelen ser semiconductores o aislantes. La estructura de zincblenda, que se muestra a continuación, puede considerarse como dos celosías fcc interpenetrantes, una de aniones y otra de cationes, compensadas entre sí por una traslación de 1/4 a lo largo de la diagonal del cuerpo de la celda unitaria. Los ejemplos de compuestos con la estructura de zincblende incluyen CuCl, CuI, ZnSe, HgS, Bes, CdTe, AlP, GaP, SnSb, CsI y diamante. Adicionalmente, el compuesto CuInSe 2 es zincblende en una celda unitaria ordenada y doblada (la estructura de calcopirita). Los compuestos de solución sólida CuIn 1 - x Ga x Se 2 con esta estructura se encuentran entre los materiales más estudiados para su uso en células fotovoltaicas eficientes de película delgada. Usando ZnS como representante del zincblende, la coordinación de ambos átomos de Zn y S es tetraédrica. La secuencia de capas, que es ABBCCAABBCC..., da como resultado anillos ZnS de seis miembros que tienen la misma geometría que la versión “silla” del ciclohexano. La conformación de la silla permite una distancia relativamente larga entre átomos opuestos en el anillo y, como resultado, es más favorable estericamente que la forma de barco. A continuación se muestra la secuencia de capas empaquetadas en zincblende, llenando solo los sitios T + y dejando vacíos los sitios T -:
- — A
- - - -b- - - T +
- - - - - - T -
- — B
- - - -c- - - T +
- - - - - - T -
- — C
- - - -a- - - T +
- - - - - - T -
|
La celda unitaria de zincblende |
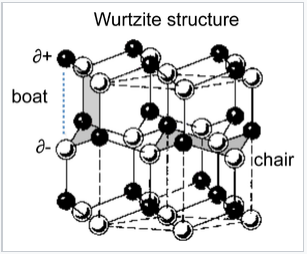
La estructura de wurtzita es un pariente cercano de la blenda de zinc, basada en llenar la mitad de los agujeros tetraédricos en la red hcp. Al igual que el zincblende, la wurtzita contiene planos de anillos fusionados de seis miembros en la conformación de la silla. Sin embargo, a diferencia del zincblende, los anillos que unen estos planos contienen anillos de “barco” de seis miembros. El barco alinea los aniones para que estén directamente por encima de los cationes en la estructura, una situación menos favorable de manera estérica pero una más favorable en cuanto a electrostática. Como resultado, la estructura de wurtzita tiende a favorecer compuestos más polares o iónicos (por ejemplo, ZnO, NH 4 + F -) que la estructura de zincblenda. Al igual que con el zincblende, ambos iones están en coordinación tetraédrica (4:4) y normalmente hay ocho electrones de valencia en el compuesto MX. Ejemplos de compuestos con esta estructura incluyen: BeO, ZnO, MnS, CdSe, MgTe, AlN y NH 4 F. La estructura estratificada de wurtzita es AbbaAbb y la secuencia de capas con sitios T + llenos se ilustra a continuación:
- — A
- - - -b- - - T +
- - - - - - T -
- — B
- - - -a- - - T +
- - - - - - T -
- — A
- - - -b- - - T +
- - - - - - T -
- — B
|
Las conformaciones de silla y barco de anillos ZnS de seis miembros en la estructura de wurtzita. |
Una consecuencia interesante del apilamiento de capas en la estructura de wurtzita es que los cristales son polares. Cuando se escinden a lo largo del eje c (el eje de apilamiento), los cristales de ZnO, ZnS y GaN tienen una cara cargada negativamente y una cara opuesta con carga positiva. Un campo eléctrico aplicado interactúa con el dipolo cristalino, dando como resultado la compresión o alargamiento de la red a lo largo de esta dirección. Por esta razón, los cristales de compuestos en la estructura de wurtzita son típicamente piezoeléctricos.
Algunos compuestos son diamórficos y pueden tener la estructura zincblende o wurtzita. Ejemplos de estos compuestos que tienen polaridades intermedias incluyen CdS y ZnS. SiO 2 existe en polimorfos (cristobalita y tridimita) que se asemejan a zincblende y wurtzita con átomos de O a medio camino entre cada uno de los átomos de Si. Las estructuras de zincblende y wurtzita tienen arreglos de empaque eficientes para redes unidas tetraédricamente y se encuentran comúnmente en compuestos que tienen unión tetraédrica. El agua, por ejemplo, tiene una red tetraédrica de enlaces de hidrógeno y es de tipo wurtzita. Las estructuras de wurtzita y blenda de zinc no distorsionadas se encuentran típicamente para compuestos AX con ocho electrones de valencia, que siguen la regla del octeto. Los compuestos AX con nueve o diez electrones como GaSe y GaAs cristalizan en variantes distorsionadas de la estructura de wurtzita. En GaSe, los electrones extra forman pares solitarios y esto crea capas en la estructura, como se puede ver en la siguiente figura. A la derecha de GaSe, las estructuras de As, Sb y SBA muestran una descomposición cada vez mayor de la estructura en capas a medida que se agregan más electrones de valencia.
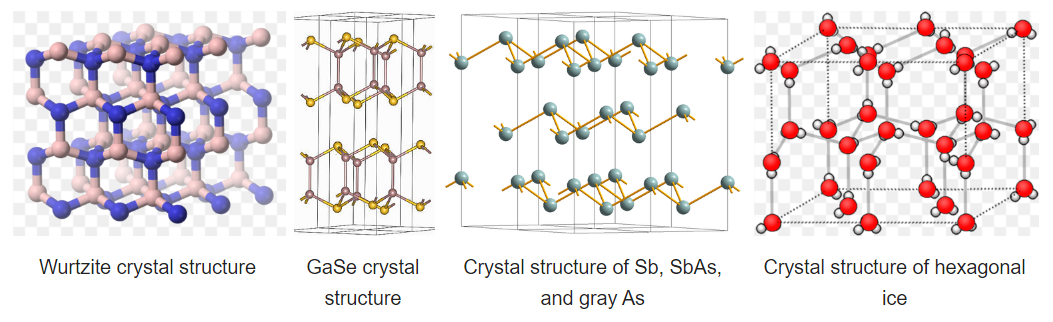
El hielo hexagonal es el polimorfo más estable del hielo, el cual se obtiene al congelarse a una presión de 1 atmósfera. Este polimorfo (Ice-I) tiene una estructura de tipo wurtzita hcp. Al observar la estructura que se muestra a la derecha, vemos que hay arreglos irregulares de los enlaces O-H-O. En la estructura, los enlaces de hidrógeno imponen la coordinación tetraédrica de cada molécula de agua, dando como resultado una estructura relativamente abierta que es menos densa que el agua líquida. Por esta razón, el hielo flota en el agua.