8.9: Problemas
( \newcommand{\kernel}{\mathrm{null}\,}\)
1. Para cada una de las siguientes secuencias de capas empaquetadas, indique el nombre de la estructura (tipo de estructura), el entorno de coordinación de los cationes (representado por letras minúsculas) y el entorno de coordinación de los aniones (letras mayúsculas). Dé dos ejemplos adicionales (aparte del tipo de estructura en sí) de compuestos con la misma estructura.
a) AbbaabbaAbb...
b) AABBCCAABBCC...
(c) Acbacbacb...
(d) AcB | AcB | AcB |... (“|” = brecha de van der Waals)
2. A continuación se muestran secciones de la celda unitaria de óxido de litio.
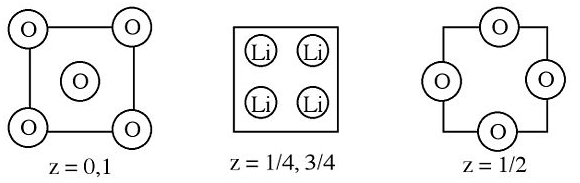
a) Describir cómo obtener (y obtener) la fórmula empírica.
b) ¿Cuál es el número de coordinación y geometría para cada tipo de ion?
(c) ¿Qué átomo está muy empaquetado?
d) ¿Qué tipo y fracción de agujeros son llenados por el otro ion?
3. La celda unitaria hexagonal de un nitruro metálico se muestra a continuación en secciones.
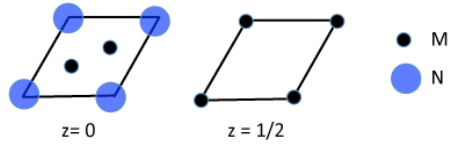
a) ¿Cuál es la fórmula empírica del compuesto?
b) ¿Cuántos átomos M se coordinan a cada átomo de N?
c) ¿En qué grupo de la tabla periódica esperaría encontrar M?
4. Dibuja la celda cúbica de la unidad Li 3 Bi en secciones.
5. Si se elimina la mitad del cesio de la estructura CsCl, de tal manera que cada átomo de Cl es entonces coordinado tetraédricamente, ¿qué tipo de estructura se genera?
6. A continuación se muestra la estructura cristalina del titanato de bario.
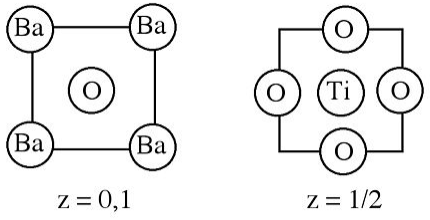
a) ¿Cuál es la fórmula empírica del compuesto?
b) ¿Qué átomos (si los hay) están empaquetados?
c) ¿Cuántos átomos de oxígeno coordinan (i) Ti 4 + y (ii) Ba 2 +?
d) ¿Por qué son diferentes los números de coordinación?
7. Las estructuras de los disulfuros (MS 2) muestran una tendencia aparentemente inusual, procediendo de izquierda a derecha a través de la serie de transición. En el lado izquierdo (TiS 2, ZrS 2, MoS 2, etc.), se encuentran estructuras en capas, mientras que en el medio (RE 2, FeS 2, RUs 2) hay estructuras tridimensionales de tipo pirita y marcasita. A la derecha (PTs 2, SnS 2), nuevamente hay estructuras en capas. Explique brevemente estas tendencias.
8. Explicar por qué los compuestos iónicos rara vez tienen estructuras cristalinas en capas.
9. Dibuja la estructura de zincblende en secciones.
10. La estructura del zincblende rara vez se encuentra con compuestos muy polares o iónicos. Sin embargo, algunos compuestos polares e iónicos (BeO, NH 4 F, etc.) tienen la estructura wurtzita.
a) Describir las similitudes y diferencias entre las estructuras zincblende y wurtzita (en términos de números de coordinación, secuencia de apilamiento de cationes y aniones, etc.) b) ¿Por qué la wurtzita es más iónica que la zincblenda?
11. Un artículo reciente de R. Cava y colaboradores (Nature Materials 2010, 9, 546-9) describe las inusuales propiedades electrónicas de una aleación de Y-Pt-Bi, cuya estructura se muestra en las secciones siguientes:
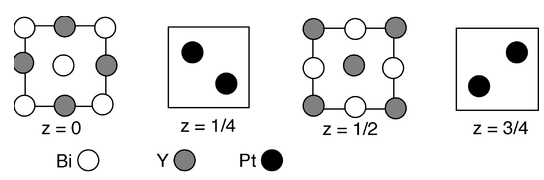
a) ¿Cuál es la estequiometría del compuesto?
(b) ¿Cuántos átomos Y y cuántos átomos de Pt coordinan cada átomo Bi?
12. La estructura de fluorita, CaF 2, que se genera llenando todos los orificios tetraédricos en una matriz FCC, es un tipo de estructura MX 2 común.
(a) ¿Cuál es el ambiente de coordinación de F en un pariente hipotético de CaF 2, en el que Ca forma una matriz hcp y F ocupa todos los sitios tetraédricos?
b) Sugerir una razón por la cual la estructura descrita en la letra a) es muy rara.
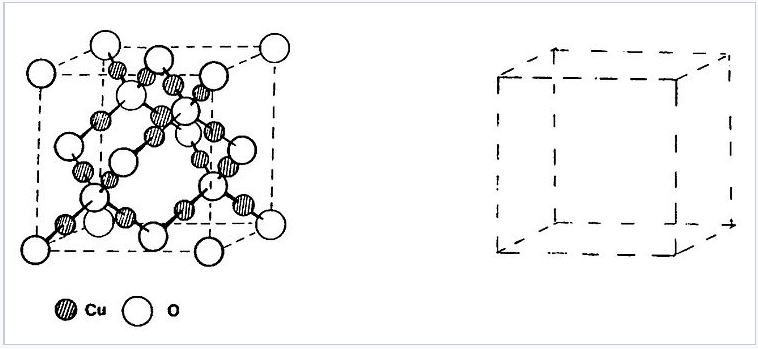
13. La estructura de cúprita (Cu 2 O) está relacionada con el zincblende (o diamante) en que el oxígeno ocupa tanto las posiciones Zn como S, con cobre en el medio. Esto se muestra esquemáticamente a la derecha. En realidad, en cúprita hay dos redes interpenetrantes de este tipo sin vínculos entre ellas. Dibuja la segunda red en la celda vacía. Si juntas las dos mitades y sacas el cobre, ¿qué celosía cúbica de empaque obtienes? ¿Es una celosía de empaque más cercana? (Pista #1: comienza con un átomo de O en 1/2,1/2,1/2) (Pista #2: prueba esto a lápiz primero)
14. Dibuje la estructura del rutilo en secciones de la celda unitaria, y verifique que la estequiometría sea MX 2. ¿Cuáles son los números de coordinación de Ti y O?
15. Stishovita es una forma de alta presión de SiO 2 que se encuentra en los cráteres de meteoritos. Mientras que el SiO 2 normal tiene la estructura de cuarzo, en la que cada Si está coordinado por cuatro átomos de O, la stishovita tiene la estructura rutilo. ¿Esperarías que el enlace Si-O sea más largo en stishovita, o en cuarzo? ¿Cuál es el orden de enlace en cada polimorfo?
16. Na y Cl se combinan en una proporción 1:1 para hacer la red de NaCl iónico. Curiosamente, predicciones teóricas recientes (confirmadas por síntesis a alta presión y cristalografía) han identificado varias otras estequiometrías que forman cristales estables a alta presión. Estos incluyen Na 3 Cl, Na 2 Cl, Na 3 Cl 2, NaCl 3 y varios otros. [8] La estructura de uno de estos nuevos cloruros de sodio se muestra a continuación en secciones.
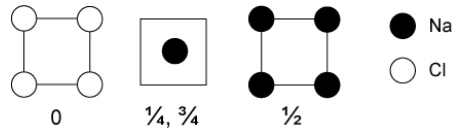
a) ¿Cuál es la estequiometría de este compuesto?
b) ¿Cuáles son los números de coordinación de Na y Cl, y cómo se comparan con los números de coordinación en NaCl y Na metal?
c) Con base en su respuesta a (b), explique por qué la alta presión debe estabilizar esta fase.
17. Uno de los nuevos compuestos descubiertos en el estudio descrito en el problema 16 es el NaCl 3. Existen dos polimorfos de este compuesto, uno de los cuales contiene iones Cl 3 lineales. Los cálculos orbitales moleculares precisos indican que la carga en el átomo central de Cl en estos aniones lineales es cercana a cero. Dibujar una estructura de enlace de valencia para el ion Cl 3 que sea consistente con estas observaciones. ¿Esperarías que el enlace Cl-Cl sea más largo o más corto que el enlace en Cl 2?
18. Algunas sales MX pueden existir en la estructura de CsCl o NaCl. Utilice la fórmula de Pauling para predecir la longitud del enlace M-X en la estructura CsCl de un compuesto que tiene una longitud de enlace de 3.5 Å en la estructura de NaCl. La aplicación de una alta presión estabilizaría la forma CsCl, o la forma NaCl de este compuesto? (sugerencia: calcular el volumen por unidad de fórmula)
19. Mn 3 O 4 y Fe 3 O 4 son ambos óxidos de valencia mixta. En ambos casos, hay un ion M 2+ y dos iones M 3+ por unidad de fórmula (M = Fe, Mn).
- (a) Una de ellas es una espinela normal y otra es una espinela inversa. Explique cuál es cuál, y por qué. (pista: pensar en CFSE)
- (b) Para Mn 3 O 4, ¿qué tipo de orden magnético (ferri-, ferro-, o antiferromagnético) esperaría, y por qué? Se puede suponer que los iones tetraédricos y octaédricos vecinos en la estructura están acoplados antiferromagnéticamente.
- c) Esbozar la forma aproximada de las curvas χ vs. T y 1/χ vs. T para Mn 3 O 4. Etiquete cualquier valor especial de temperatura en sus gráficas.
20. Predecir si cada una de las siguientes debe formar una espinela normal o inversa: MgV 2 O 4, VMg 2 O 4, NiGa 2 O 4, ZnCr 2 S 4, NiFe 2 O 4. ¿Un tipo de orden magnético (ferro-, ferri-, o antiferromagnético) predeciría para NiFe 2 O 4?


