9.7: Estabilización de Estados de Alta y Baja Oxidación
- Page ID
- 72195
Las energías de celosía, además de guiar el descubrimiento de compuestos desconocidos, son útiles para explicar la ausencia (es decir, la inestabilidad termodinámica) de compuestos inexistentes. [8] Por ejemplo, CuF y AuF son compuestos desconocidos, mientras que CuF 2, AuF 3 y AuF 5 son estables. En contraste, el aGF es un compuesto conocido y estable.
Del ciclo Born Haber para CuF, el compuesto debe ser marginalmente estable (ΔH f o = -140 kJ/mol) con respecto a los elementos. ¿Por qué entonces se desconoce el CuF?
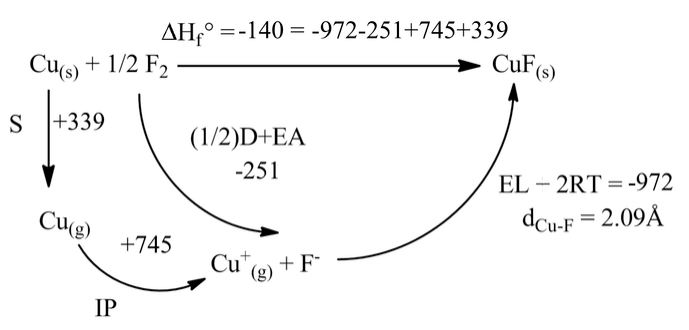
Para conocer esta pregunta, primero construimos un ciclo Born-Haber para la formación de CuF 2 a partir de los elementos. Este compuesto es estable con respecto a los elementos por -368 kJ/mol.
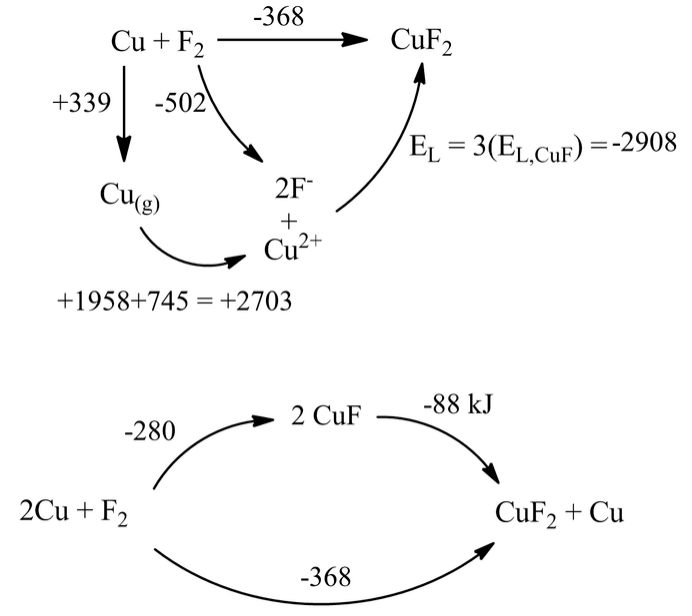
Combinando los dos ciclos vemos que la desproporción de CuF a Cu y CuF 2 es espontánea. A partir de ciclos similares, también podemos predecir que la reacción 3AuF → AuF 3 + 2Au debe ser espontánea.
¿Por qué el estado de oxidación más bajo es inestable para estos fluoruros? El punto clave es que la gran diferencia en los valores de E L (2908-972=1926 kJ en el caso de fluoruros de cobre) impulsa sus reacciones de desproporción. Tenga en cuenta que cuando usamos la ecuación de Kapustinskii, calculamos que E L para CuF 2 es aproximadamente tres veces la de CuF. Usamos los mismos radios univalentes en ambos cálculos, pero el Cu tiene una carga 2+ en CuF 2 (duplicando la energía de la red en relación con CuF), y contiene 3/2 tantos iones. El producto z + z - n es así tres veces mayor para CuF 2. La diferencia en los valores de E L aumentará así a medida que aumente E L para la sal monovalente. Sabemos que los fluoruros, que tienen un radio aniónico pequeño, darán valores E L mayores que los yoduros, que tienen aniones más grandes. Así, la reacción de desproporción se vuelve más favorable para el CuF que para el CuI.
Por lo tanto, la estabilidad del estado de oxidación menor vs mayor depende del tamaño del anión. Por ejemplo, en fluoruros, el CuF es inestable pero el CuF 2 es estable. Sin embargo, en los yoduros, el CuI es estable mientras que el CuI 2 es inestable. A partir de esto podemos desarrollar una conclusión amplia: los aniones pequeños (O, F) tienden a estabilizar estados de oxidación más altos, mientras que los aniones grandes (S, Br, I...) estabilizan estados de oxidación inferiores. Tenga en cuenta que esta tendencia tiene que ver con el tamaño y no con la electronegatividad del anión. Casualmente, F y O son elementos electronegativos, pero realmente es su pequeño tamaño lo que tiene consecuencias para la energía reticular y su estabilización de estados de oxidación más altos.
|
El yoduro cuproso (CuI) es un compuesto cristalino utilizado en síntesis orgánica y siembra de nubes. Este compuesto se puede elaborar en el laboratorio haciendo reaccionar sales solubles de Cu 2+ con una solución de yoduro de sodio o potasio. Debido a que el CuI 2 es termodinámicamente inestable, la reacción libera I 2 y se forma un precipitado de CuI. |
Recuerde que las reglas ácido-base duras y blandas podrían interpretarse en términos de la dominancia de las interacciones iónicas vs. covalentes. Aquí hemos puesto la interacción duro-dura en términos cuantitativos, basada en energías de celosía (electrostáticas).
Ag parece contrarrestar la tendencia periódica. ¿Por qué el aGF es estable? Esto se debe a que la segunda IP es muy alta (2071 kJ vs 1958 kJ para Cu, 1979 para Au). Así tanto aGF como AgF 2 son fluoruros conocidos de Ag.



