1.1: Conceptos de unión en química de grupos principales
- Page ID
- 69308
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivos de aprendizaje
En esta conferencia aprenderás lo siguiente:
- Estructura de Lewis.
- Limitaciones del modelo Lewis.
Química Organometálica de Elementos del Grupo Principal
Nuestro objetivo en este curso es introducir una de las disciplinas importantes de la química inorgánica que une los compuestos orgánicos con el grupo principal y elementos de transición; la química organometálica. La química organometálica se define como la química de compuestos químicos que contienen uno o más enlaces metal-carbono que son esencialmente polares (M δ+ —C δ-) en la naturaleza. Para empezar es necesario comprender los conceptos de vinculación que explican las estructuras tanto del grupo principal como de los elementos de transición. Los objetivos de las primeras conferencias son dar una idea de las diversas interacciones metal-ligando que luego ayudarían a planificar la síntesis y, finalmente, a investigar su estabilidad electrónica y cinética. El curso se divide en cuatro secciones principales y la primera se ocupa de los diversos conceptos de unión empleados tanto para el grupo principal como para los compuestos de metales de transición. Las secciones segunda y tercera tratan sobre la química organometálica del grupo principal y elementos de transición, respectivamente, mientras que la cuarta sección estaría dedicada a aplicaciones de compuestos organometálicos con especial énfasis en la catálisis.
Un conjunto de problemas junto con soluciones se presentan al final y también en el Capítulo 2. En el futuro, se planea proporcionar secciones interactivas también.
Al final se listan la literatura y los libros pertinentes en esta y otras áreas afines.
Estructura molecular y unión
Las propiedades químicas de las moléculas pueden correlacionarse directamente con sus estructuras electrónicas. En esta conferencia se intenta dar una visión general de cómo evolucionó el concepto de vinculación a partir del enfoque de Lewis para el desarrollo de la teoría orbital molecular.
1.1.1: Estructuras de Lewis
Lewis propuso que cuando dos átomos se acerquen entre sí para establecer un enlace compartiendo un par de electrones, se establecerá un enlace covalente. Un par de electrones daría un enlace sencillo X—Y; dos o tres pares de electrones conducirían a la formación de dobles (X=Y) y triples enlaces (X=Y), respectivamente. Los pares de electrones de valencia que no se utilizan en la unión se denominan pares solitarios de electrones o simplemente pares solitarios. El par solitario de electrones no participa en la unión; sin embargo, sí influyen en la forma y la geometría de la molécula y sus propiedades químicas también.
Lewis introdujo la regla del octeto que establece que cada átomo comparte sus electrones de valencia con los átomos vecinos para tener un total de ocho (s 2 p 6) electrones en su capa de valencia para tener configuración de gas noble-gas. Una excepción a esta regla es el hidrógeno ya que solo puede tener dos electrones de valencia en su única capa, 1s.
Simplemente contando el número de electrones de valencia presentes en el átomo central y sus vecinos, las estructuras de Lewis se pueden escribir en solo tres sencillos pasos.
- Considera los electrones de valencia de todos los átomos participantes; suma un electrón por cada carga negativa y resta un electrón por cada carga positiva.
- Identificar el átomo central y escribir los símbolos de los átomos alrededor del átomo central. En la mayoría de las moléculas poliatómicas, la menos electronegativa será el átomo central con excepción de los hidruros, por ejemplo, H 2 O, NH 3 o H 2 S.
- Distribuir los pares de electrones por toda la molécula para satisfacer el octeto de todos los átomos presentes en la molécula partiendo del más electronegativo. Cada par de átomos unidos individualmente requiere un par de electrones.
- Cada par de enlaces debe estar representado por un enlace sencillo y se supone que la carga neta es poseída por el ion (catión o anión) como un todo y no por un átomo individual.
Para algunas moléculas, la estructura de puntos de Lewis difiere de las observaciones estructurales determinadas experimentalmente. Por ejemplo, en el ion acetato ambos enlaces C-O son idénticos según la determinación de la estructura de rayos X, pero la predicción por la estructura de Lewis es incorrecta. El motivo se debe a la resonancia.

Limitaciones del modelo Lewis
Las moléculas con número impar de electrones nunca pueden satisfacer la regla del octeto.
Ejemplo: NO.
Algunos átomos con menos electrones de valencia nunca pueden completar el octeto sin cargas formales.
Un átomo central puede tener más de 8 electrones. Ejemplo: El modelo SF 6
Lewis no explica la naturaleza paramagnética de O 2.
La geometría y las formas moleculares no pueden ser explicadas por el modelo de Lewis.
Ejemplos trabajados
Ejemplo 1: ClO 2 -
Solución:
ClO 2 - Número total de electrones 7 + 2 x 6 + 1 = 20 = 10 pares
Identificar el átomo central y conectar el átomos periféricos con un par de electrones como dos puntos y cuentan los pares de electrones restantes
\(\ce{O:Cl:O}\) 20-4 = 16 electrones a la izquierda (8 pares)
Completar el octeto de átomos de oxígeno y contar los pares de electrones restantes
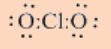 16-12 = 4 electrones
16-12 = 4 electrones
Completa el octeto de átomo de cloro,
 Dado que todos los electrones son utilizados y el octeto está satisfecho, no hay necesidad de ningún enlace múltiple.
Dado que todos los electrones son utilizados y el octeto está satisfecho, no hay necesidad de ningún enlace múltiple.
La estructura es o
o o
o
Ejemplo 2: CO
Solución:
CO (monóxido de carbono) Número total de electrones 4 + 6 = 10
Conecta los dos átomos con un par de electrones como dos puntos y cuenta los pares de electrones restantes
\(\ce{C:O}\) 10-2 = 8 electrones a la izquierda
Completar el octeto de átomos de oxígeno y contar los pares de electrones restantes
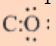 8-6 = 2 electrones
8-6 = 2 electrones
Colocar el par de electrones restante en el átomo de carbono, Se utilizan
 todos los electrones y el octeto no se satisface para el carbono ya que hay escasez de cuatro electrones más.
todos los electrones y el octeto no se satisface para el carbono ya que hay escasez de cuatro electrones más.
 Arrastre dos pares de electrones sobre el átomo de oxígeno entre carbono y oxígeno para establecer dos enlaces más de manera que exista un triple enlace entre C y O que satisfaga el octeto tanto de C como de O.
Arrastre dos pares de electrones sobre el átomo de oxígeno entre carbono y oxígeno para establecer dos enlaces más de manera que exista un triple enlace entre C y O que satisfaga el octeto tanto de C como de O.
La estructura es:C: ::O: o:C=O: o |C=O|
Problemas:
Elaborar estructuras Lewis para: BF 4 -, PCl 3, PO 4 3-, SO 4 2-, O 3, N 2 y SO 2


