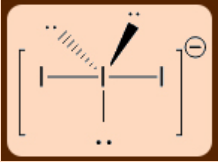
1.2: Teoría VSEPR y su utilidad
- Page ID
- 69309
Objetivos de aprendizaje
En esta conferencia aprenderás lo siguiente
- Definición de VSEPR.
- Concepto de hibridación.
- Predicción de formas y geometrías de moléculas.
- La regla de Bent y su aplicación en la comprensión de los parámetros estructurales.
La teoría de la repulsión de pares de electrones de la concha de valencia (VSEPR)
La teoría VSEPR es una mejora y extensión del modelo de Lewis pero predice las formas de las moléculas poliatómicas. Este modelo fue sugerido por primera vez por Nevil Sidgwick y Herbet Powell en 1940 y posteriormente mejorado por Ronald Gillespie y Ronald Nyholm.
La predicción de formas moleculares y geometrías fue fácil gracias a este modelo a través de los siguientes sencillos pasos.
- Dibuja la estructura de Lewis.
- Contar el número total de enlaces y pares solitarios alrededor del átomo central. (Cada enlace sencillo implicaría un par de electrones).
- Organice los pares de unión y los pares solitarios en una de las geometrías estándar para minimizar la repulsión electrón-electrón.
- Los electrones de pares solitarios permanecen más cerca del núcleo y también se extienden sobre un espacio más grande que los pares de enlaces y, por lo tanto, grandes ángulos entre pares solitarios.
- La repulsión sigue el orden LP-LP > LP-BP > BP-BP.
- Los enlaces múltiples deben considerarse como una sola región de unión.
Números estéricos:
Otro término llamado número estérico se utiliza a menudo en la teoría de VSEPR.
Número estérico (SN) = No. de átomo unido + No. de pares solitarios. Dado que las repulsiones de pares solitarios y pares solitarios son máximas, la geometría más estable se puede obtener maximizando la distancia entre los números estéricos en el átomo central.
Las formas moleculares se determinan eventualmente por dos parámetros: Distancia de enlace, separación entre los núcleos de dos átomos unidos en línea recta y el ángulo de enlace, el ángulo entre dos enlaces cualesquiera que contienen un átomo común.
Si bien se mencionan las formas moleculares, los pares solitarios pueden ignorarse, sin embargo, al definir la geometría, se deben considerar tanto los pares solitarios como los pares de enlaces.
Por ejemplo: en la molécula de agua el átomo de oxígeno central se encuentra en ambiente tetraédrico con dos pares solitarios y dos enlaces O-H (o dos pares de enlaces). Por lo tanto, la forma de la molécula de agua se dobla (se ignoran dos pares solitarios).
De manera similar, en amoníaco, el átomo de nitrógeno se encuentra en ambiente tetraédrico con tres pares enlazados (tres enlaces N-H) y un par solitario. La forma de la molécula NH 3 es piramidal.
Predecir las geometrías moleculares
Para empezar, dibuja la estructura de Lewis.
Contar el número de pares de unión y pares solitarios alrededor del átomo central.
Organice los pares de unión y los pares solitarios en una de las geometrías estándar, minimizando así la repulsión electrón-electrón.
Los enlaces múltiples cuentan como una sola región de unión.
Cuál es la regla de Bent: Los sustituyentes
más electronegativos 'prefieren' orbitales híbridos que tienen menos carácter s, y los sustituyentes más electropositivos 'prefieren' orbitales que tienen más caracteres s.
Los ángulos de unión en CH 4, CF 4 y CH 2 F 2 se pueden explicar usando la regla de Bent. Mientras que un carbono en CH 4 y CF 4 utiliza cuatro híbridos sp ³ idénticos para la unión, en CH 2 F 2 los híbridos utilizados no son idénticos.
Los enlaces C-F se forman a partir de híbridos sp 3 + x, con un poco más de carácter p y menos carácter s que un híbrido sp ³, y el hidrógeno está unido por híbridos sp 3 - x, con ligeramente menos carácter p y un poco más carácter s. Al aumentar la cantidad de carácter p en los enlaces C-F se disminuye el ángulo de unión F-C-F, ya que para la unión por orbitales p puros el ángulo de unión disminuiría a 90°.
Formas moleculares determinadas por la teoría VSEPR
|
Molécula |
Número Estérico |
Geometría |
Ejemplo |
|
MA 2 |
2 |
Lineal |
BecL 2 |
|
MA 3 |
3 |
Plano trigonal |
BF 3 |
|
MA 4 |
4 |
Tetraédrico |
SiF 4 |
|
MA 5 |
5 |
Trigonal bipiramidal |
PF 5 |
|
MA 6 |
6 |
Octaédrica |
SF 6 |
|
MA 7 |
7 |
Pentagonal bipiramidal |
SI 7 |
|
Molécula |
SN |
Número de pares solitarios |
Geometría |
forma |
Ejemplo |
|
MA 2 |
2 | 0 |
Lineal |
CO 2 |
|
|
MA 3 |
3 3 |
0 1 |
Plano trigonal |
|
SO 3 |
|
MA 4 |
4 | 0 1 2 |
Tetraédrico |
Tetraédrico |
CH 4 |
|
MA 5 |
5 | 0 1 2 3 |
Trigonal bipiramidal |
|
|
|
MA 6 |
6 | 0 1 2 |
Octaédrica |
|
SF 6 |
Problemas:
1. Dibujar la estructura y representar la geometría alrededor de los átomos de Se en [Se 3 O 6 F 3] 3-, que es una molécula iónica simétrica con estructura cíclica, utilizando el modelo VSEPR.
Solución
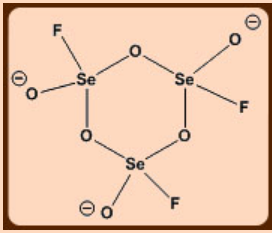
Aplicar la teoría VSEPR a la estructura.
Se tiene seis electrones de valencia. Un Se—F y tres Se—O (un terminal y dos puentes) agregarán cuatro electrones más a la capa de valencia de Se, por lo que, 10 e = 5 pares de electrones de los cuales cuatro son pares unidos y uno es un par solitario. Se espera un entorno de TBP.
2. Predecir y dibujar la estructura de I 3 + usando el modelo VSEPR.
Solución
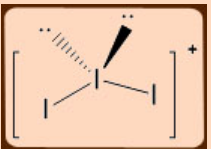
El número total de electrones en el átomo central I es: 7 + 2 -1 (carga) = 8; 2BP + 2LP, debe ser de forma tetraédrica y angular.
3. ¿Cuál de H 2 O y F 2 O tendrá el mayor ángulo de unión X-O-X?
Solución:
F es más electronegativo que H; por lo tanto, el espacio ocupado por el par de unión O-H en la carcasa de valencia O será mayor. Por lo tanto, H 2 O tendrá el mayor ángulo de unión X-O-X.
4. Explicar por qué los ángulos de enlace X-P-X para la serie de moléculas POX 3 disminuyen de X = Br (104.1°) a X = Cl (103.3°) a X = F (101.3°)
Solución: El
flúor es el halógeno más electronegativo, por lo que alejará la densidad de electrones en el enlace P-F del átomo de P; la repulsión de los pares de unión P-F será menor que la repulsión de los pares de unión P-Cl y P-Br, por lo que el ángulo de enlace F-P-F será el más pequeños.
5. Demostrar que las siguientes moléculas y sus formas correspondientes son correctas, utilizando la teoría VSEPR.
| BCl 3, | plano trigonal |
| [IF5] 2-, | plano pentagonal |
| [NH 4] +, | tetraédrico |
| SF 6; | octaédrico |
| xEF 4; | plano cuadrado |
| AsF 5; | bipiramidal trigonal |
| Xe (O) F 4, | pirámide cuadrada |
| SI 7, | pentagonal bipiramidal |
| [H 3 O] + | tetraédrico |
| H 2 Se | tetraédrico |
6. Calcular la geometría de I 3 - ion usando el modelo VSEPR.
Solución