2.1: Métodos generales de preparación
- Page ID
- 69068
Objetivos de aprendizaje
En esta sección aprenderás lo siguiente
- Diversas metodologías sintéticas para hacer enlaces M—C.
- Cómo elegir un método sintético apropiado.
- Condiciones de reacción y el papel de los disolventes
Un compuesto organometálico contiene uno o más enlaces metal-carbono.
Síntesis
Métodos generales de preparación
La mayoría de los compuestos organometálicos se pueden sintetizar usando una de las cuatro reacciones de formación de enlaces M-C de un metal con un haluro orgánico, desplazamiento de metal, metátesis e hidrometalación.
a. Reacción con metal y transmetalación
La reacción neta de un metal electropositivo M y un hidrocarburo sustituido con halógeno es
\[\ce{ 2 M} + \ce{R X} (\text{alkyl or aryl}) \ce{-> MR + MX}\]
Por ejemplo
\[\ce{ 8 Li + 4CH3Cl -> Li4(CH3)4 + 4LiCl}\]
\[\ce{ Mg + CH3Br -> CH3MgBr (organometal\:halide\:with\:Mg, Al, Zn)}\]
Si, un átomo de metal toma el lugar de otro, se llama transmetalación
\[\ce{ M + M'R -> M' + MR}\]
\[\ce{ 2Ga + 3CH3-Hg-CH3 -> 3Hg + 2Ga(CH3)3}\]
La transmetalación es favorable cuando el metal desplazante es mayor en la serie electroquímica que el metal desplazado.
b. Metátesis
La metátesis de un compuesto organometálico MR y un haluro binario EX es una ruta sintética ampliamente utilizada en la química organometálica.
\[\ce {MR + EX -> ER + MX}\]
\[\ce {Li4(CH3)4 + SiCl4 -> 4LiCl + Si(CH3)4}\]
\[\ce {Al2(CH3)6 + 2BF3 -> 2AlF3 + 2B(CH3)3}\]
La reacción de metátesis se puede predecir frecuentemente a partir de la electronegatividad o consideraciones ácido-base duras y blandas.
Los grupos hidrocarbonados tienden a enlazarse al elemento más electronegativo; el halógeno favorece la formación de compuestos iónicos con el metal más electropositivo.
En resumen, el grupo alquilo y arilo tiende a migrar del elemento menos al más electronegativo [χ = electronegatividad].
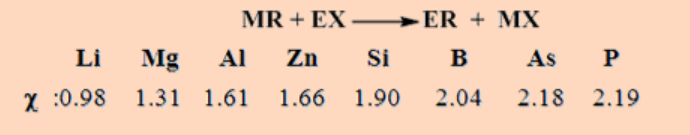
Cuando las electronegatividades son similares, se puede predecir el resultado correcto, con cuidado, considerando la combinación del elemento más blando con el grupo orgánico y el elemento más duro con fluoruro o cloruro.
*Un producto insoluble o reactivo puede cambiar el resultado, p.
\[\ce{SnPh4(THF) + HgBr2(THF) -> HgPhBr(s) + PhSnBr (THF)}\]
HgPhBr resulta ser insoluble en THF Las reacciones de
metátesis que involucran el mismo elemento central a menudo se denominan reacciones de redistribución.
\[\ce{SiCl4 + SiMe4 -> Me3SiCl + Me2SiCl2 + ...}\]
\[\ce{3GeCl4 + 2AlMe6 -> 3GeMe4 + 4AlCl3}\]
Al es más electropositivo que Ge, esta reacción ocurre ya que es termodinámicamente favorable.
c. Hidrometalación
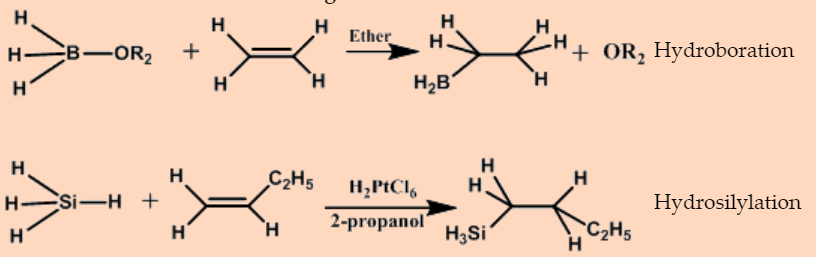
El resultado neto de la adición de un hidruro metálico a un alqueno es un compuesto alquilmetálico.
\[\ce{EH + H2C=CH2 -> E-CH2-CH3}\]
La reacción es impulsada por la alta resistencia del enlace E-C en relación con la mayoría de los enlaces E-H, y ocurre con una amplia variedad de compuestos que contienen enlaces E-H.
Hidroboración
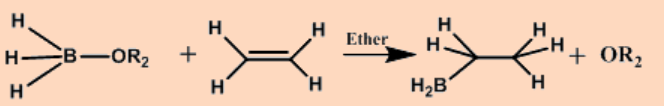
Hidrosililación
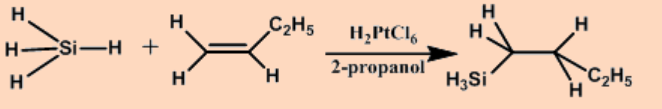
Compuestos iónicos y deficientes en electrones del Grupo 1, 2
Se conocen los derivados organometálicos de todos los metales del Grupo 1. Entre ellos, los compuestos de alquillitio son los reactivos más estudiados y útiles.
Muchos de ellos están disponibles comercialmente.
MeLi generalmente se maneja en solución de éter, pero los compuestos de RLi con cadenas más largas son solubles en hidrocarburos.
Preparación comercial:
\[\ce{M + RX -> MR (often \: contaminated \: with \: halide)}\]
El mejor método sería:
\[\ce{HgR2 + 2Li -> 2LiR + Hg}\]
MeLi existe como un cúmulo tetraédrico en estado sólido y en solución. Muchos de sus homólogos superiores existen en solución como hexámeros o mezcla de equilibrio de agregados que van hasta los haxámeros.
Los agregados más grandes pueden ser desagregados por bases de Lewis, como TMEDA.
Los compuestos de organolitio comunes tienen un Li por grupo orgánico.
Se conocen varias moléculas orgánicas polilitiadas que contienen varios átomos de litio por molécula.
El ejemplo más simple es Li 2 CH 2, que se puede preparar mediante la pirólisis de MeLi que cristaliza en una estructura antifulorita* distorsionada. Sin embargo, aún no se han establecido los detalles más finos de la orientación de los grupos CH 2.
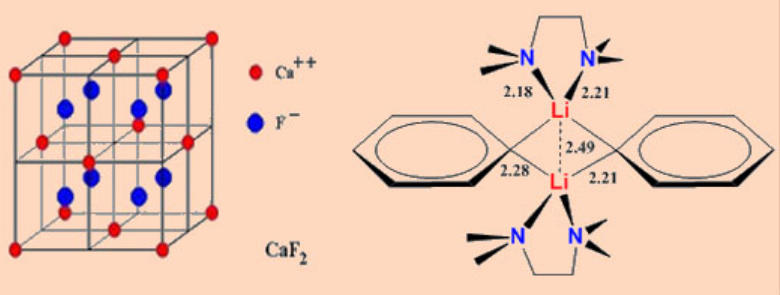
*la estructura antifluorita es la inversa de la estructura de fluorita en la que se invierten las ubicaciones de cationes y aniones. Observe las estructuras de CaF 2 (estructura de fluorita) y K 2 O (estructura antifluorita). Una matriz fcc de cationes y todos los agujeros tetraédricos están llenos de aniones.
Sales aniónicas radicales
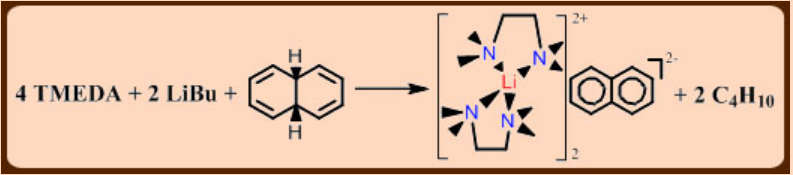
La naftalida de sodio es un ejemplo de una sal organometálica con un anión radical deslocalizado, C 10 H 8 -.
Dichos compuestos se preparan fácilmente haciendo reaccionar un compuesto aromático con un metal alcalino en un disolvente aprótico polar.
La naftalina disuelta en THF reacciona con Na metal para producir una solución verde oscuro de naftalida de sodio.
\[\ce{Na(s) + C10H8(THF) -> Na[C10H8](THF)}\]
Los espectros de EPR muestran que el electrón impar se deslocaliza en un orbital antienlace de C 10 H 8.
La formación de anión radical es más favorable cuando el π de LUMO del areno es bajo en energía.
La MOT simple predice que la energía de LUMO disminuye de manera constante al pasar del benceno a los hidrocarburos conjugados más extensamente.
La naftalida sódica y compuestos similares son agentes reductores altamente reactivos.
Se prefieren al sodio porque a diferencia del sodio, son fácilmente solubles en éteres.
La reacción homogénea resultante es generalmente más rápida y fácil de controlar que una reacción heterogénea entre un reactivo en solución y trozos de metal de sodio, que a menudo están recubiertos con óxido de sodio no reactivo o con productos de reacción insolubles.
La ventaja adicional es que mediante la elección adecuada del grupo aromático se puede elegir el potencial de reducción del reactivo para que coincida con los requisitos de una tarea sintética particular.
La ruta alternativa al anión deslocalizado es la escisión reductora de enlaces C-H ácidos por un compuesto de metal alcalino o alquilmetálico.
Ejemplo:
Problemas:
1. Clasificar las siguientes reacciones en, (i) hidrometalación, desplazamiento metálico, metátesis O reacciones de transmetalación; (ii) dar un ejemplo para cada caso en forma de una ecuación química equilibrada.
Solución
a. \[\ce{M + Mx’R -> M’ + MR}\]... Transmetalación
por ejemplo:\[\ce{2Ga + 3CH3-Hg-CH3 -> 3Hg + 2Ga(CH3)3}\]
b.\[\ce{MR + EX → ER + MX}\]... Metátesis
e.g.:\[\ce{Li4(CH3)4 + SiCl4 -> 4LiCl +Si(CH3)4}\] o\[\ce{Al2(CH3)6 + 2BF3 -> 2AlF3 + 2B(CH3)3}\]
c.\[\ce{EH + H2C=CH2 -> E—CH2—CH3 }\]... Hidrometalación
por ejemplo:
Problemas:
2. Para cada uno de los siguientes compuestos, indicar aquellos que pueden servir como
(1) un buen reactivo nucleófilo carbanión,
(2) un ácido de Lewis suave,
(3) una base de Lewis suave en el átomo central,
(4) un agente reductor fuerte. (Un compuesto puede tener más de una de estas propiedades)
(a) Li 4 (CH 3) 4, (b) Zn (CH 3) 2, (c) (CH 3) MgBr, (d) B (CH 3) 3, (e) Al 2 (CH 3) 6, (f) Si (CH 3) 4, (g) As (CH 3) 3.
Solución
- (MeLi) 4 - buen nucleófilo carbanión y agente reductor fuerte
- ZnMe 2 - nucleófilo carbanión razonable, ácido de Lewis suave, agente reductor
- MemGbr - buen nucleófilo carbanión
- BMe 3 - ácido de Lewis suave
- Al 2 Me 6 - buen nucleófilo carbanión, agente reductor fuerte
- SiMe 4 - ácido de Lewis suave
- ASMe 3 - base Lewis suave


