3.1: Reacciones de Compuestos Organometálicos
- Page ID
- 69281
Objetivos de aprendizaje
En esta sección aprenderás lo siguiente
- Propiedades químicas de los compuestos organometálicos.
- Patrones de reactividad y sus propiedades electrónicas.
- Propiedades electrónicas frente a reactividad química.
- Aplicación de alquil litio en transformaciones orgánicas.
Reacciones de compuestos organometálicos
Las reacciones de compuestos organometálicos de elementos electropositivos están dominadas por factores como el carácter carbanión de la fracción orgánica y la disponibilidad de un sitio de coordinación en el átomo metálico central. Patrones de reacción:
a. Oxidación
- Todos los compuestos organometálicos son potencialmente agentes reductores.
- Los de los elementos electropositivos son de hecho agentes reductores muy fuertes (muchos de ellos son de naturaleza pirofórica).
- El fuerte carácter reductor también presenta un riesgo potencial de explosión si los compuestos se mezclan con mayor cantidad de agentes oxidantes.
¿Por qué es así?
Todos los compuestos organometálicos de los metales electropositivos que tienen orbitales de valencia sin llenar, o que se disocian fácilmente en fragmentos con orbitales sin llenar son pirofóricos, por ejemplo,\(\ce{Li4(CH3)4}\),\(\ce{Zn(CH3)2}\),\(\ce{B(CH3)3}\) y\(\ce{Al2(CH3)6}\)
Los compuestos pirofóricos volátiles, tales como\(\ce{B(CH3)3}\), pueden manejarse en línea de vacío y, se utilizan técnicas de atmósfera inerte para compuestos menos volátiles pero sensibles al aire. Compuestos como\(\ce{Si(CH3)4}\) y\(\ce{Sn(CH3)4}\) que no tienen orbitales vacíos bajos, requieren temperaturas elevadas para iniciar la combustión, y pueden manejarse en el aire.
La combustión de muchos compuestos organometálicos tiene lugar por un mecanismo de cadena radical.
b. Carácter nucleofílico
La carga negativa parcial de un grupo orgánico unido a un metal electropositivo lo convierte en un nucleófilo fuerte y base de Lewis. Esto se conoce como su carácter carbanión a pesar de que el compuesto en sí no es iónico. Los compuestos de alquillitio y alquilaluminio y los reactivos de Grignard son los reactivos carbaniones más comunes en la química sintética a escala de laboratorio. El carácter carbanión disminuye para el boro y silicio menos metálicos.
El carácter carbanión encuentra muchas aplicaciones sintéticas.
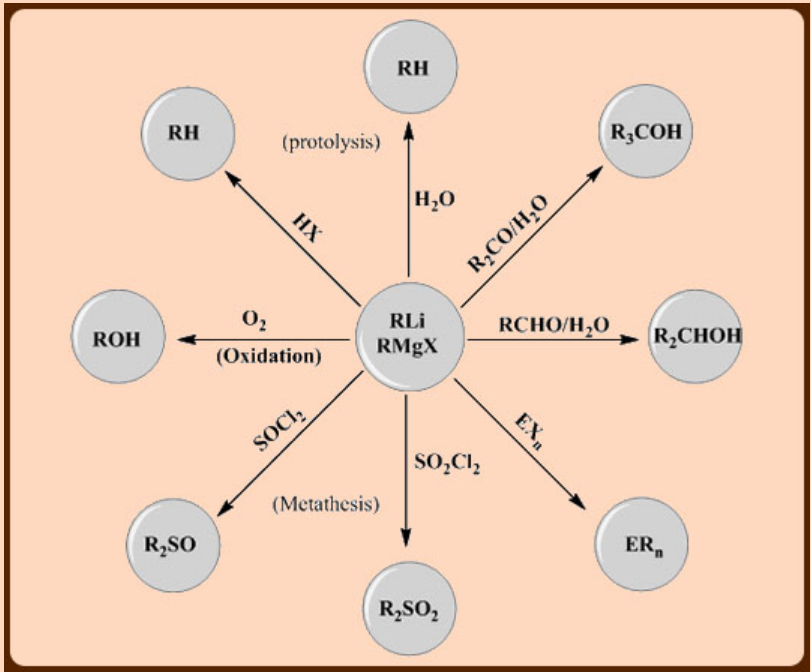
Donde X = haluro, E = B, Si, Ge, Sn, Pb, As y Sb
c. Acidez de Lewis
Debido a la presencia de orbitales desocupados en el átomo metálico, se observa que los compuestos organometálicos deficientes en electrones son ácidos de Lewis.
por ejemplo\[\ce{B(C6H5)3 + LiC6H5 -> Li[B(C6H5)4]}\]
Esta reacción puede verse como la transferencia de la base fuerte C 6 H 5 - del ácido débil de Lewis Li + al ácido más fuerte B (III).
Las especies organometálicas que están puenteadas por grupos orgánicos también pueden servir como ácidos de Lewis y, en el proceso, puede tener lugar la escisión del puente.
\[\ce{Al2(CH3)6 + 2N(C2H5)3 -> 2(CH3)3AlN(C2H5)3}\]
Las especies organometálicas deficientes en electrones son los ácidos de Lewis.
Problemas
1. Nombrar cada uno de los siguientes compuestos y clasificarlos: (a) SiH (CH 3) 3, (b) BCl (C 6 F 5) 2, (c) Al 2 Cl 2 (C 6 H 5) 4, (d) Li 4 (C 4 H 9) 4, e) Rb (CH 2 H 3).
Solución
- trimetilsilano (monómero tetraédrico, electrón-preciso);
- bis (pentafluorofenil) cloroborano (monómero trigonal, deficiente en electrones);
- tetrafenildiclorodialuminio (dos puentes Al-Cl-Al, en esta forma estructural es electrón —preciso);
- butillitio o, más precisamente, tetrabutiltetralitio (matriz tetraédrica de Li 4 con un carbono de fenilo que une cada cara, deficiente en electrones);
- etilrubidio, similar a la sal.
2. Esbozar las estructuras de: (a) metil litio, (b) trimetilboro, (c) hexametildialuminio, (d) tetrametilsilano, (e) trimetilarsano y (f) tetrafenilarsonio.
Solución
- metil litio: Tetraedro de Li con cada cara cubierta por CH 3 [ver capítulo 6]
- trimetil boro: matriz triangular plana de B y C
- hexametildialuminio: cuatro terminales CH 3 y dos puentes CH 3 en una estructura tipo diborano
- tetrametilsilano: tetraédrico
- trimetilarsano: piramidal
- tetrafenilarsonio: pseudotetraédrico


